题目内容
15.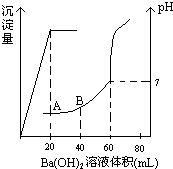 有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol.L-1氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示.求:
有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25mol.L-1氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如图所示.求:(1)滴定前盐酸和硫酸的物质的量浓度各为多少?
(2)在B点时的pH是多少?(已知lg2=0.3)
(无计算过程不得分)
分析 (1)设溶液中盐酸的浓度为xmol/L,硫酸的浓度为ymol/L,根据当加入20mL氢氧化钡溶液时沉淀达到最大量可知:ymol/L×0.01L=0.25mol/L×0.02L ①
然后根据当加入60mL氢氧化钡溶液时,混合溶液显中性,故有:xmol/L×0.01L+ymol/L×2×0.01L=0.25mol/L×2×0.06L ②
将①②联立可解得xy;
(2)在B点时,加入的氢氧化钡的体积为40mL,溶液显酸性,即酸过量,根据c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{V(酸)+V(碱)}$来计算,并求出pH.
解答 解:(1)设溶液中盐酸的浓度为xmol/L,硫酸的浓度为ymol/L,由于当加入20mL氢氧化钡溶液时沉淀达到最大量,即加入的氢氧化钡恰好将硫酸根沉淀完全,可知:ymol/L×0.01L=0.25mol/L×0.02L ①
而当加入60mL氢氧化钡溶液时,混合溶液显中性,即加入的氢氧化钡中的OH-的物质的量与酸溶液中的H+的物质的量相等,故有:xmol/L×0.01L+ymol/L×2×0.01L=0.25mol/L×2×0.06L ②
将①②联立可解得x=2mol/L,y=0.5mol/L.
答:滴定前溶液中的盐酸的浓度为2mol/L,硫酸的浓度为0.5mol/L.
(2)在B点时,加入的氢氧化钡的体积为40mL,溶液显酸性,即酸过量,混合溶液中的c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{V(酸)+V(碱)}$=$\frac{2,mol/L×0.01L+0.5mol/L×2×0.01L-0.25mol/L×2×0.04L}{0.01L+0.04L}$=0.2mol/L,故溶液中的pH=-lgc(H+)=0.7.
答:B点时溶液的pH为0.7.
点评 本题考查了酸碱中和滴定的过程中的pH的有关计算,难度不大,应注意的是混合后溶液显什么性就先求什么离子的浓度.

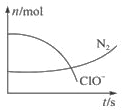 某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程存在H2O、ClO-、CN-、HCO3-、N2、Cl-6种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 当有3 mol ClO-参加反应时,则有1 mol N2生成 | |
| B. | HCO3-作为碱性介质参与反应 | |
| C. | 当有5 mol ClO-参加反应时,则有1 mol N2生成 | |
| D. | 若生成2.24 L N2,则转移电子0.6 mol |
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=$\frac{{K}_{2}}{{K}_{1}}$(用K1、K2表示).
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有CE(填写字母序号).
A、缩小反应容器的容积 B、扩大反应容器的容积 C、升高温度
D、使用合适的催化剂 E、设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:
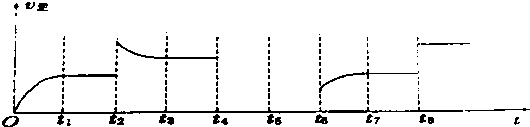
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时增大生成物浓度或升高温度,t8时加入催化剂或加压.
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线.
| A. | 10% | B. | 33.3% | C. | 50% | D. | 66.7% |
| A. | Ca2(OH)(PO4)3 | B. | Ca3(OH)(PO4)3 | C. | Ca4(OH)(PO4)3 | D. | Ca5(OH)(PO4)3 |
 已知A、B、D、E均为中学化学常见物质,它们之间的转化关系如图所示(部分产物略去,①②③④的反应条件均相同).则A、E可能的组合为( )
已知A、B、D、E均为中学化学常见物质,它们之间的转化关系如图所示(部分产物略去,①②③④的反应条件均相同).则A、E可能的组合为( )①CO2、NaOH溶液;②Ca(HCO3)2溶液、Ca(OH)2溶液;③Na、O2;
④CuO、C;⑤AlCl3溶液、NH3•H2O ⑥NaAlO2溶液、盐酸.
| A. | ①③⑤ | B. | ①④⑤ | C. | ①④⑥ | D. | ①②⑥ |
数据编号 | 加入NaOH溶液的体积/mL | 溶液的pH | ||
| C(HX) | c(HY) | |||
| ① | 0 | 4 | 1 | |
| ② | a | 7 | ||
| ③ | 20.00 | x | y | |
| A. | 由表中数据可估算出25℃时Ka(HX)≈10-8 | |
| B. | 在相同温度下,物质的量浓度相同的两种酸溶液的导电能力为HX<HY | |
| C. | 编号②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) | |
| D. | 编号③反应的溶液中:c(X-)>c(Y-) |