题目内容
20.实验室还可以利用以下反应制取氯气:KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O(1)该反应的还原产物是Cl2,每生成1mol Cl2转移的电子数为$\frac{5}{3}$mol.
(2)若要制取标准状况下5.6升Cl2,则至少需要KClO3多少g?写出计算过程.
分析 (1)所含元素化合价降低的反应物为氧化剂,氧化剂发生还原反应得到还原产物;
根据氯气物质的量计算参加反应KClO3的物质的量,再根据氯酸钾中Cl元素化合价变化计算转移电子;
(2)根据n=$\frac{V}{{V}_{m}}$计算氯气物质的量,根据方程式计算需要氯酸钾的物质的量,再根据m=nM计算氯酸钾的质量.
解答 解:(1)反应中KClO3中Cl元素化合价由+5价降低为Cl2中0价,Cl2是还原产物,而HCl中Cl元素化合价由-1价升高为Cl2中0价,Cl2也是氧化产物,
由方程式可知,生成1mol Cl2需要KClO3的物质的量为1mol×$\frac{1}{3}$,则转移电子为1mol×$\frac{1}{3}$×5=$\frac{5}{3}$mol,
故答案为:Cl2;$\frac{5}{3}$mol;
(2)标况下5.6L氯气物质的量为$\frac{5.6L}{22.4L/mol}$=0.5mol,
KClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O
1 3
x 0.5mol
所以x=$\frac{0.5mol×1}{3}$=$\frac{1}{6}$mol
故需要氯酸钾的质量为$\frac{1}{6}$mol×122.5g/mol=20.4g,
答:至少需要KClO3约是20.4g.
点评 本题考查氧化还原反应计算、化学方程式计算,比较基础,根据化合价理解氧化还原反应基本概念,注意氧化还原反应中价态归中不交叉规律.

练习册系列答案
相关题目
10.在1000℃时,可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数K=2.如果在充有一定量CO2的恒容密闭容器中加入足量的Fe,在1000℃时使之发生上述反应,达平衡时CO2的转化率为( )
| A. | 10% | B. | 33.3% | C. | 50% | D. | 66.7% |
15.下列化合物在加热时不能与新制Cu(OH)2反应的是( )
| A. | CH3CHO | B. | CH3CH2OH | C. | HCOOH |
5.25℃时,用浓度为0.10mol•L-1的氢氧化钠溶液分别滴定20.00mL,浓度均为0.10二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断正确的是( )
数据编号 | 加入NaOH溶液的体积/mL | 溶液的pH | ||
| C(HX) | c(HY) | |||
| ① | 0 | 4 | 1 | |
| ② | a | 7 | ||
| ③ | 20.00 | x | y | |
| A. | 由表中数据可估算出25℃时Ka(HX)≈10-8 | |
| B. | 在相同温度下,物质的量浓度相同的两种酸溶液的导电能力为HX<HY | |
| C. | 编号②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) | |
| D. | 编号③反应的溶液中:c(X-)>c(Y-) |
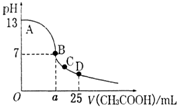 室温下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,pH 与滴加 CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )
室温下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,pH 与滴加 CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )