题目内容
下列说法中不正确的是( )
| A、1mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L |
| B、等体积、浓度均为1mol/L的碳酸和盐酸,电离出的氢离子数之比为2:1 |
| C、1mol臭氧和1.5mol氧气含有相同的氧原子数 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含氧原子数之比为1:3 |
考点:阿伏加德罗常数,物质的量的相关计算
专题:计算题,阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n
=
计算判断;
B、碳酸是弱酸存在电离平衡;
C、依据臭氧、氧气的分子式计算氧原子数;
D、依据二氧化碳分子式和葡萄糖分子式计算氧原子数之比.
| N |
| NA |
| V |
| 22.4 |
B、碳酸是弱酸存在电离平衡;
C、依据臭氧、氧气的分子式计算氧原子数;
D、依据二氧化碳分子式和葡萄糖分子式计算氧原子数之比.
解答:
解:A、依据n
=
计算,1mol 氧气中含有氧原子数=1mol×2×6.02×1023=12.04×1023个氧原子,在标准状况下占有体积22.4 L,故A正确;
B、碳酸是弱酸存在电离平衡,等体积、浓度均为1mol/L的碳酸和盐酸,电离出的氢离子数之比小于2:1,故B错误;
C、1mol臭氧含有相同的氧原子数3mol,1.5mol氧气含有相同的氧原子数3mol,1mol臭氧和1.5mol氧气含有相同的氧原子数,故C正确;
D、等物质的量的干冰二氧化碳和葡萄糖(C6H12O6)中所含氧原子数之比为1:3,故D正确;
故选B.
| N |
| NA |
| V |
| 22.4 |
B、碳酸是弱酸存在电离平衡,等体积、浓度均为1mol/L的碳酸和盐酸,电离出的氢离子数之比小于2:1,故B错误;
C、1mol臭氧含有相同的氧原子数3mol,1.5mol氧气含有相同的氧原子数3mol,1mol臭氧和1.5mol氧气含有相同的氧原子数,故C正确;
D、等物质的量的干冰二氧化碳和葡萄糖(C6H12O6)中所含氧原子数之比为1:3,故D正确;
故选B.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是物质的量和各物理量的换算关系,掌握基础是关键,题目较简单.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
按图1的装置进行试验,若图2中X轴表示阴极的电子的量,则Y轴可能表示为( )


| A、Cu2+物质的量浓度 |
| B、C棒的质量 |
| C、Fe棒的质量 |
| D、Cl-物质的量浓度 |
如图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
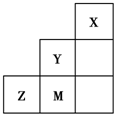 ??
??
 ??
??| A、非金属性:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、Z元素最高价氧化物的对应水化物的浓溶液具有强氧化性和不挥发性 |
| D、三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
下列关于稀有气体的叙述正确的是( )
| A、原子的最外电子层都有8个电子 |
| B、化学性质非常不活泼 |
| C、其原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布 |
| D、原子半径比同周期ⅦA族元素原子的小 |
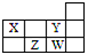 四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )
四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )| A、X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B、Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C、X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D、W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |
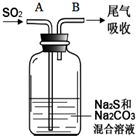 硫、氯及其化合物有广泛的用途.
硫、氯及其化合物有广泛的用途. 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下: