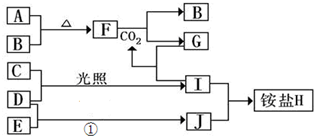
题目内容
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题.
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?
CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K= .
②实验3中,若平衡时,CO的转化率大于水蒸气,则
的值 (填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正 V逆(填“<”,“>”,“=”).
(2)已知在常温常压下:写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: .
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol?L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 mol/L.
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似.请写出该电池负极上的电极反应式: .
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则
| a |
| b |
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正
(2)已知在常温常压下:写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol?L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似.请写出该电池负极上的电极反应式:
考点:化学平衡常数的含义,热化学方程式,化学电源新型电池,难溶电解质的溶解平衡及沉淀转化的本质,离子浓度大小的比较
专题:化学平衡专题,电化学专题
分析:(1)①化学平衡常数K=
;
②若平衡时,CO的转化率大于水蒸气,则
>
;
③根据浓度商与化学平衡常数相对大小判断反应方向,从而确定正逆反应速率相对大小;
(2)根据盖斯定律书写;
(3)草酸氢钠(NaHC2O4)溶液显酸性,说明草酸氢根离子电离程度大于水解程度,但水解和电离程度都较小;
(4)c(CaCl2)=
;
(5)该燃料电池中,负极上燃料失电子发生氧化反应.
| c(CO2).c(H2) |
| c(CO).c(H2O) |
②若平衡时,CO的转化率大于水蒸气,则
| a-d |
| a |
| c |
| b |
③根据浓度商与化学平衡常数相对大小判断反应方向,从而确定正逆反应速率相对大小;
(2)根据盖斯定律书写;
(3)草酸氢钠(NaHC2O4)溶液显酸性,说明草酸氢根离子电离程度大于水解程度,但水解和电离程度都较小;
(4)c(CaCl2)=
| Ksp |
| c(Na2CO3) |
(5)该燃料电池中,负极上燃料失电子发生氧化反应.
解答:
解:(1)①平衡时c(CO)=
=0.8mol/L,c(H2)=
=0.2mol/L,c(H2O)=
=0.6mol/L,c(CO2)=c(H2)=
=0.2mol/L,
化学平衡常数K=
=
=
或0.17,
故答案为:
或0.17;
②根据方程式知,参加反应的CO的物质的量等于生成氢气的物质的量,所以a-d=c,若平衡时,CO的转化率大于水蒸气,则
>
,
<
=1,其转化率大于0,所以0<
<
=1,
故答案为:<1 (填0<a/b<1亦可);
③c(CO)=c(H2)=c(H2O)=c(CO2)=
=0.5mol/L,浓度商=
=1>K,说明平衡向逆反应方向移动,则V正<V逆,故答案为:<;
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
将方程式
+2③得CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=
+2×(-44.0kJ/mol)=-442.8 kJ∕mol
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol;
(3)二者恰好反应生成草酸氢钠,草酸氢钠溶液呈酸性c(H+)>c(OH-),则草酸氢根离子电离和水电离都生成氢离子,草酸氢根离子水解和电离程度较小,所以离子浓度大小顺序是c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(4)混合溶液中c(Na2CO3)=1×10-4mol/L,根据溶度积常数得混合溶液中c(CaCl2)=
mol/L=2.8×10-5mol/L,二者等体积混合时溶质浓度降为原来的一半,所以原来氯化钙浓度为5.6×10-5mol/L,故答案为:5.6×10-5;
(5)该燃料电池中,负极上二甲醚失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OCH3-12e-+3H2O=3CO2+12H+,故答案为:CH3OCH3-12e-+3H2O=3CO2+12H+.
| 1.6mol |
| 2L |
| 0.4mol |
| 2L |
| (1-0.4)mol |
| 2L |
| 0.4mol |
| 2L |
化学平衡常数K=
| c(CO2).c(H2) |
| c(CO).c(H2O) |
| 0.2×0.2 |
| 0.8×0.3 |
| 1 |
| 6 |
故答案为:
| 1 |
| 6 |
②根据方程式知,参加反应的CO的物质的量等于生成氢气的物质的量,所以a-d=c,若平衡时,CO的转化率大于水蒸气,则
| a-d |
| a |
| c |
| b |
| a |
| b |
| a-d |
| c |
| a |
| b |
| a-d |
| c |
故答案为:<1 (填0<a/b<1亦可);
③c(CO)=c(H2)=c(H2O)=c(CO2)=
| 1mol |
| 2L |
| 0.5×0.5 |
| 0.5×0.5 |
(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
将方程式
| ①-② |
| 2 |
| ( -1275.6kJ/mol)-( -566.0kJ/mol) |
| 2 |
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol;
(3)二者恰好反应生成草酸氢钠,草酸氢钠溶液呈酸性c(H+)>c(OH-),则草酸氢根离子电离和水电离都生成氢离子,草酸氢根离子水解和电离程度较小,所以离子浓度大小顺序是c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(4)混合溶液中c(Na2CO3)=1×10-4mol/L,根据溶度积常数得混合溶液中c(CaCl2)=
| 2.8×10-9 |
| 1×10-4 |
(5)该燃料电池中,负极上二甲醚失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OCH3-12e-+3H2O=3CO2+12H+,故答案为:CH3OCH3-12e-+3H2O=3CO2+12H+.
点评:根据化学平衡常数公式、盖斯定律、原电池原理、盐类水解、难溶物的溶解平衡等知识点来分析解答,考查知识面较广,同时考查学生对知识点掌握及综合运用能力,易错点是(4)题,第一次要正确计算混合溶液中碳酸钠浓度,第二次要将根据溶度积常数计算出的氯化钙浓度转化为原溶液浓度,为易错点.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
下列说法中不正确的是( )
| A、1mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L |
| B、等体积、浓度均为1mol/L的碳酸和盐酸,电离出的氢离子数之比为2:1 |
| C、1mol臭氧和1.5mol氧气含有相同的氧原子数 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含氧原子数之比为1:3 |
BHT是一种常用的食品抗氧化剂,从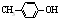 出发合成BHT的方法有如图两种.下列说法错误的是( )
出发合成BHT的方法有如图两种.下列说法错误的是( )
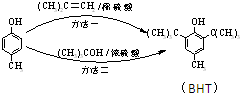
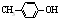 出发合成BHT的方法有如图两种.下列说法错误的是( )
出发合成BHT的方法有如图两种.下列说法错误的是( )
| A、两种方法的反应类型都是加成反应 |
| B、BHT在水中的溶解度小于苯酚 |
C、BHT与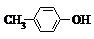 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 |
| D、从绿色化学角度分析方法一优于方法二 |
2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷.下列有关说法不正确的是( )
| A、丙烷和丁烷互为同系物,化学性质相似 |
| B、丙烷和丁烷的特征反应均为取代反应 |
| C、C3H8没有同分异构体,C4H10有两种同分异构体 |
| D、等质量的丙烷和丁烷完全燃烧时,后者耗氧量大 |
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、L2+与R2-的核外电子数相等 |
| B、气态氢化物的热稳定性:H2T>H2R |
| C、M与T形成的化合物能溶于氨水溶液 |
| D、相同条件下,单质与同浓度稀盐酸反应的速率:M>L |