题目内容
如图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
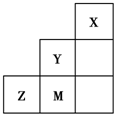 ??
??
 ??
??| A、非金属性:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、Z元素最高价氧化物的对应水化物的浓溶液具有强氧化性和不挥发性 |
| D、三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
考点:元素周期律和元素周期表的综合应用
专题:
分析:由元素在短周期中的位置可知,X为He、Y为F、M为Cl、Z为S,
A.同周期自左而右非金属性最强,同主族自上而下非金属性减弱;
B.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
C.浓硫酸具有强氧化性,不挥发;
D.F元素没有最高价含氧酸.
A.同周期自左而右非金属性最强,同主族自上而下非金属性减弱;
B.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
C.浓硫酸具有强氧化性,不挥发;
D.F元素没有最高价含氧酸.
解答:
解:由元素在短周期中的位置可知,X为He、Y为F、M为Cl、Z为S,
A.同周期自左而右非金属性最强,同主族自上而下非金属性减弱,故非金属性:Y>M>Z,故A错误;
B.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->F-,故B错误;
C.浓硫酸具有强氧化性和不挥发性,故C正确;
D.F元素没有最高价含氧酸,故D错误,
故选C.
A.同周期自左而右非金属性最强,同主族自上而下非金属性减弱,故非金属性:Y>M>Z,故A错误;
B.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->F-,故B错误;
C.浓硫酸具有强氧化性和不挥发性,故C正确;
D.F元素没有最高价含氧酸,故D错误,
故选C.
点评:本题考查元素周期表与元素周期律,难度不大,注意掌握微粒比较比较.

练习册系列答案
相关题目
下列说法中不正确的是( )
| A、1mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L |
| B、等体积、浓度均为1mol/L的碳酸和盐酸,电离出的氢离子数之比为2:1 |
| C、1mol臭氧和1.5mol氧气含有相同的氧原子数 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含氧原子数之比为1:3 |
BHT是一种常用的食品抗氧化剂,从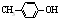 出发合成BHT的方法有如图两种.下列说法错误的是( )
出发合成BHT的方法有如图两种.下列说法错误的是( )
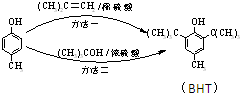
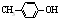 出发合成BHT的方法有如图两种.下列说法错误的是( )
出发合成BHT的方法有如图两种.下列说法错误的是( )
| A、两种方法的反应类型都是加成反应 |
| B、BHT在水中的溶解度小于苯酚 |
C、BHT与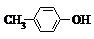 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 |
| D、从绿色化学角度分析方法一优于方法二 |
同温同压下,A容器中氯化氢与B容器中氨气所含原子数相等,两容器体积之比为( )
| A、1:4 | B、2:1 |
| C、1:2 | D、4:1 |
2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷.下列有关说法不正确的是( )
| A、丙烷和丁烷互为同系物,化学性质相似 |
| B、丙烷和丁烷的特征反应均为取代反应 |
| C、C3H8没有同分异构体,C4H10有两种同分异构体 |
| D、等质量的丙烷和丁烷完全燃烧时,后者耗氧量大 |
H2A是一种弱酸,已知常温下0.1mol/L NaHA溶液呈酸性.关于该溶液中微粒浓度的以下判断中,可能错误的是( )
| A、c(A2-)+c(OH-)=c(H2A)+c(H+) |
| B、c(HA-)>c(A2-)>c(H2A) |
| C、c(HA-)>c(H+)>c(OH-) |
| D、c(HA-)>c(OH-)>c(A2-) |
三氟化氮(NF3)是一种无色、无臭的气体,在潮湿的空气中能与水蒸气反应,产物有NO、HNO3和HF.下列说法错误的是( )
| A、反应中被氧化与被还原的元素,其原子的物质的量之比为1:2 |
| B、NF3与NH3化学性质的不同是因F与H两元素非金属性的差异引起 |
| C、NF3一旦泄漏,可用NaOH溶液喷淋,只有NaF、NaNO3和H2O产生 |
| D、若反应中转移0.2mol电子,则生成的NO气体体积约为4.48L(标准状况) |
 A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积均为V L.
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积均为V L.