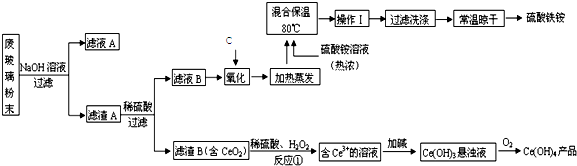
题目内容
 硫、氯及其化合物有广泛的用途.
硫、氯及其化合物有广泛的用途.(1)工业上通过电解饱和食盐水生产氯气.在立式隔膜式电解槽中铁电极上的电极反应式为
(2)“氯氧化法”是指在碱性条件下用Cl2将废水中的CN-氧化成无毒的物质.用化学符号写出CN-被氧化后的产物
(3)“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3→NH2Cl+HCl,生成的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用.
①氯胺能用于消毒杀菌的原因是
②经氯胺消毒法处理后的水中,氮元素多以NH4+的形式存在.已知:
NH4+(aq)+1.5O2(g)→NO2-(aq)+2H+(aq)+H2O(l)+273kJ
NH4+(aq)+2O2(g)→NO3-(aq)+2H+(aq)+H2O(l)+346kJ
NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为
(4)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,发生反应时氧化剂与还原剂的物质的量之比为
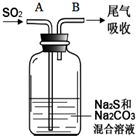
如图所示装置和药品可用来制备Na2S2O3.
| 资料:25℃时 | |
| H2CO3 | Ki1=4.4×10-7 |
| H2S | Ki1=1.3×10-7 |
| H2SO3 | Ki1=1.54×10-2 |
(5)通入一定量SO2后,在B处检测到有新的气体生成.判断B处排出的气体中是否可能有H2S?并说明理由
(6)为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因是
考点:电解原理,热化学方程式,氧化还原反应的计算,氯、溴、碘及其化合物的综合应用
专题:元素及其化合物
分析:(1)工业上通过电解饱和食盐水生产氯气,阳极应为惰性电极,则铁为阴极;
(2)碱性条件下用Cl2将废水中的CN-氧化成无毒的物质,应生成HCO3-(或者CO32-)、N2;
(3)NH2Cl能部分水解生成强氧化性的物质,应为HClO,可起消毒杀菌的作用;结合盖斯定律书写热化学方程式;
(4)Na2S2O3中S元素化合价为+2价,可被氧化生成+6价S,结合化合价的变化判断;
(5)根据表中数据结合硫化氢的还原性判断;
(6)S2O32-在酸性溶液中不能稳定存在.
(2)碱性条件下用Cl2将废水中的CN-氧化成无毒的物质,应生成HCO3-(或者CO32-)、N2;
(3)NH2Cl能部分水解生成强氧化性的物质,应为HClO,可起消毒杀菌的作用;结合盖斯定律书写热化学方程式;
(4)Na2S2O3中S元素化合价为+2价,可被氧化生成+6价S,结合化合价的变化判断;
(5)根据表中数据结合硫化氢的还原性判断;
(6)S2O32-在酸性溶液中不能稳定存在.
解答:
解:(1)工业上通过电解饱和食盐水生产氯气,阳极应为惰性电极,则铁为阴极,电解饱和食盐水,阴极发生还原反应,电极方程式为2H++2e=H2,
故答案为:2H++2e=H2;
(2)碱性条件下用Cl2将废水中的CN-氧化成无毒的物质,应生成HCO3-(或者CO32-)、N2,故答案为:HCO3-(或者CO32-)、N2;
(3)①NH2Cl能部分水解生成强氧化性的物质,应为HClO,可起消毒杀菌的作用,方程式为NH2Cl+H2O?NH3+HClO,
故答案为:NH2Cl+H2O?NH3+HClO;
②已知:
①NH4+(aq)+1.5O2(g)→NO2-(aq)+2H+(aq)+H2O(l)+273kJ
②NH4+(aq)+2O2(g)→NO3-(aq)+2H+(aq)+H2O(l)+346kJ
利用盖斯定律,将2×(②-①)可得2NO2- (aq)+O2(g)→2NO3-(aq)+146 kJ,
故答案为:2NO2- (aq)+O2(g)→2NO3-(aq)+146 kJ;
(4)Na2S2O3中S元素化合价为+2价,可被氧化生成+6价S,则1molNa2S2O3共失去8mol电子,而1mol氯气被还原可得到2mol电子,则发生反应时氧化剂与还原剂的物质的量之比为4:1,
故答案为:4:1;
(5)由表中数据可知,H2SO3酸性强于H2S,溶液中的S2-与H2SO3反应能生成H2S,由于S2-还原性较强,能被SO2氧化生成单质硫,可可能没有硫化氢,
故答案为:可能有H2S,因为由电离常数可知H2SO3酸性强于H2S,溶液中的S2-与H2SO3反应能生成H2S,或可能没有H2S,因为S2-还原性较强,能被SO2氧化生成单质硫;
(6)S2O32-在酸性溶液中不能稳定存在,可自身发生歧化反应生成硫和亚硫酸钠,应保持pH大于7,
故答案为:通入过多SO2会使溶液的pH小于7,S2O32-在酸性溶液中不能稳定存在.
故答案为:2H++2e=H2;
(2)碱性条件下用Cl2将废水中的CN-氧化成无毒的物质,应生成HCO3-(或者CO32-)、N2,故答案为:HCO3-(或者CO32-)、N2;
(3)①NH2Cl能部分水解生成强氧化性的物质,应为HClO,可起消毒杀菌的作用,方程式为NH2Cl+H2O?NH3+HClO,
故答案为:NH2Cl+H2O?NH3+HClO;
②已知:
①NH4+(aq)+1.5O2(g)→NO2-(aq)+2H+(aq)+H2O(l)+273kJ
②NH4+(aq)+2O2(g)→NO3-(aq)+2H+(aq)+H2O(l)+346kJ
利用盖斯定律,将2×(②-①)可得2NO2- (aq)+O2(g)→2NO3-(aq)+146 kJ,
故答案为:2NO2- (aq)+O2(g)→2NO3-(aq)+146 kJ;
(4)Na2S2O3中S元素化合价为+2价,可被氧化生成+6价S,则1molNa2S2O3共失去8mol电子,而1mol氯气被还原可得到2mol电子,则发生反应时氧化剂与还原剂的物质的量之比为4:1,
故答案为:4:1;
(5)由表中数据可知,H2SO3酸性强于H2S,溶液中的S2-与H2SO3反应能生成H2S,由于S2-还原性较强,能被SO2氧化生成单质硫,可可能没有硫化氢,
故答案为:可能有H2S,因为由电离常数可知H2SO3酸性强于H2S,溶液中的S2-与H2SO3反应能生成H2S,或可能没有H2S,因为S2-还原性较强,能被SO2氧化生成单质硫;
(6)S2O32-在酸性溶液中不能稳定存在,可自身发生歧化反应生成硫和亚硫酸钠,应保持pH大于7,
故答案为:通入过多SO2会使溶液的pH小于7,S2O32-在酸性溶液中不能稳定存在.
点评:本题考查较为综合,涉及电解、盖斯定律、物质的制备以及检验等知识,侧重与学生的分析能力和实验能力的考查,为高频考点,注意把握相关基础知识的学习,难度中等.

练习册系列答案
相关题目
 如图是甲醇/过氧化氢燃料电池内部结构示意图.工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能.下列说法不正确的是( )
如图是甲醇/过氧化氢燃料电池内部结构示意图.工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能.下列说法不正确的是( )| A、该电池的正极反应式:H2O2+2H++2e-═2H2O |
| B、燃料腔中的多孔石墨电极为该燃料电池的负极,负极产生的H+通过质子交换膜流向正极 |
| C、电池工作时,1mol甲醇被氧化有6 mol电子转移 |
| D、电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路 |
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、常温下,pH=7的任何溶液中含有OH-数目均为10-7NA |
| B、23g乙醇中含有C-H键的数目为3NA |
| C、4.8g O2和O3以任何比例组成的混合气体中含有的氧原子数目均为0.3NA |
| D、常温常压下,2.24L Cl2与足量铁粉充分反应,转移的电子数目为0.2NA |
下列说法中不正确的是( )
| A、1mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L |
| B、等体积、浓度均为1mol/L的碳酸和盐酸,电离出的氢离子数之比为2:1 |
| C、1mol臭氧和1.5mol氧气含有相同的氧原子数 |
| D、等物质的量的干冰和葡萄糖(C6H12O6)中所含氧原子数之比为1:3 |
 A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积均为V L.
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积均为V L.