题目内容
2.软锰矿(主要成分是MnO2)与过量KOH和KClO3固体在高温下反应,生成K2MnO4和KCl,其反应化学方程式为 MnO2+KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+KCl+H2O(未配平)下列说法中正确的是( )| A. | 反应中MnO2是氧化剂 | |
| B. | 氧化产物与还原产物物质的量之比为1:3 | |
| C. | KClO3在反应中失去电子 | |
| D. | 反应中每生成l mol K2MnO4,氧化剂得到2 mol电子 |
分析 Mn元素的化合价由+4价升高为+6价,Cl元素的化合价由+5价降低为-1价,由电子、原子守恒可知反应为3MnO2+6KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O,以此来解答.
解答 解:A.Mn元素的化合价升高,MnO2是还原剂,故A错误;
B.氧化产物为K2MnO4,还原产物为KCl,由反应可知氧化产物与还原产物物质的量之比为3:1,故B错误;
C.KClO3在反应中得到电子,故C错误;
D.反应中每生成3 mol K2MnO4,氧化剂得到6 mol电子,则反应中每生成l mol K2MnO4,氧化剂得到2 mol电子,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的应用,题目难度不大.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 冰醋酸、纯碱、明矾、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | 电解质是在水溶液或熔融状态下能导电的化合物 | |
| C. | 在含有1 mol Fe(OH)3的胶体中,含有NA个Fe(OH)3胶粒 | |
| D. | 玻璃棒在化学实验中只起到搅拌的作用 |
13.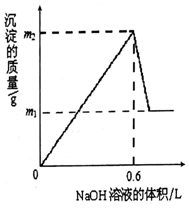 将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
 将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )| A. | m1-m2═10.2 | B. | 2c(H2SO4)+c(HNO3)═0.8 mol•L-1 | ||
| C. | 原合金中铝的质量分数为34.7% | D. | V=2.24 |
11.0.01mol Al投入100mL 3mol•L-1 NaOH溶液中充分反应后,再滴入1mol•L-1 H2SO4 120mL,其结果( )
| A. | 溶液的pH<7 | B. | 得到澄清透明溶液 | ||
| C. | 得到浑浊液 | D. | 先有白色沉淀生成,后逐渐溶解 |
12.下列说法正确的是( )
| A. | 某放热反应能自发进行,因此该反应是熵增反应 | |
| B. | 用惰性电极电解含有 H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子 | |
| C. | 反应 A(g)?B(g)△H,若正反应的活化能为 EakJ/mol,逆反应的活化能为 EbkJ/mol,则△H=-(Ea-Eb)kJ/mol | |
| D. | 3x%的 A 物质的溶液与 x%的 A 物质的溶液等体积混合后溶液质量分数小于 2x%,则 A 可 能为乙醇 |