题目内容
13.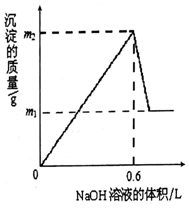 将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )| A. | m1-m2═10.2 | B. | 2c(H2SO4)+c(HNO3)═0.8 mol•L-1 | ||
| C. | 原合金中铝的质量分数为34.7% | D. | V=2.24 |
分析 由图可知加NaOH生成沉淀,则酸无剩余,Cu、Al失去电子,N得到电子,且图中酸碱恰好中和时生成沉淀最多,继续加NaOH,氢氧化铝溶解,m1-m2为氢氧化铝的质量,结合电子、原子守恒计算.
解答 解:设合金中Cu为xmol,Al为ymol,则
①64x+27y=m1,
②2x+3y=0.6L×1mol/L=$\frac{V}{22.4}$×(5-2)
③y=$\frac{{m}_{1}}{98}$
解得x=0.1mol,y=0.13mol,V=4.48L,
A.m1-m2为氢氧化铝的质量,为0.13mol×78g/mol=10.2g,故A正确;
B.n(NO)=0.2mol=n(HNO3),n(H+)=0.6mol,n(H2SO4)=$\frac{0.6-0.2}{2}$=0.2mol,2c(H2SO4)+c(HNO3)═0.6 mol•L-1,故B错误;
C.原合金中铝的质量分数为$\frac{0.13mol×27g/mol}{0.1mol×64g/mol+0.13mol×27g/mol}$×100%=34.7%,故C正确;
D.由上述分析可知,V=4.48L,故D错误;
故选BD.
点评 本题考查混合物的计算,为高频考点,把握图象与反应的对应关系、发生的反应为解答的关键,侧重分析与计算能力的考查,注意电子、原子守恒的应用,题目难度不大.

练习册系列答案
相关题目
4.下列表述正确的是( )
| A. | 比例模型为 ,可以表示甲烷分子,也可以表示四氯化碳分子 ,可以表示甲烷分子,也可以表示四氯化碳分子 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 二氧化硫、氨、煤的液化均为物理变化 | |
| D. | 实验室中制取乙酸乙酯的方程式为CH3COOH+H18O-C2H5CH3COOC2H5+H218O |
18.在298K、1.01×10-3Pa下,将32gSO2通入750mL.1mol/LNaOH溶液中,充分反应,测得反应放出aKJ的热量.已知在该条件上,1molSO2通1L2mol/LNaOH溶液中,充分反应放出bKJ的热量.则SO2与NaOH溶液反应生成NaHSO3的热化学方程式是( )
| A. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(2a-b)kJ/mol | |
| B. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(4b-a)kJ/mol | |
| C. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(a-4b)kJ/mol | |
| D. | SO2(g)+NaOH(aq)═NaHSO3(aq)△H=-(4a-b)kJ/mol |
5.某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
(1)他们能完成哪些因素对速率影响的探究?硝酸浓度、温度、大理石表面积.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
(3)整个实验中应控制的不变量是硝酸溶液体积和大理石质量.
(4)该实验小组用如图实验装置进行实验.
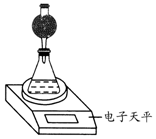
①除电子天平、干燥管、锥形瓶、药匙、胶塞、量筒等仪器外,必需的实验仪器还有秒表.
②干燥管中应放置的试剂是B.
A.碱石灰 B.无水CaCl2C.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
(1)他们能完成哪些因素对速率影响的探究?硝酸浓度、温度、大理石表面积.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 细颗粒 | 2.00 |
| ② | 常温 | 细颗粒 | 1.00 |
| ③ | 35℃ | 粗颗粒 | 2.00 |
| ④ | 35℃ | 细颗粒 | 2.00 |
(4)该实验小组用如图实验装置进行实验.

①除电子天平、干燥管、锥形瓶、药匙、胶塞、量筒等仪器外,必需的实验仪器还有秒表.
②干燥管中应放置的试剂是B.
A.碱石灰 B.无水CaCl2C.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
2.软锰矿(主要成分是MnO2)与过量KOH和KClO3固体在高温下反应,生成K2MnO4和KCl,其反应化学方程式为 MnO2+KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+KCl+H2O(未配平)下列说法中正确的是( )
| A. | 反应中MnO2是氧化剂 | |
| B. | 氧化产物与还原产物物质的量之比为1:3 | |
| C. | KClO3在反应中失去电子 | |
| D. | 反应中每生成l mol K2MnO4,氧化剂得到2 mol电子 |
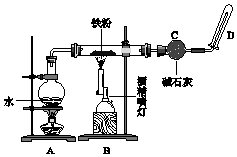 完成实验Fe与水蒸气反应,如图所示.
完成实验Fe与水蒸气反应,如图所示. NaHNa+[:H]- CsOH
NaHNa+[:H]- CsOH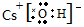 HSCN
HSCN O22-
O22- .
.