题目内容
17.实验室常用加热氯酸钾和二氧化锰的混合物来制取氧气.当氯酸钾完全反应后,剩余固体为氯化钾和二氧化锰的混合物.现要提取出其中的氯化钾,并用实验方法检验其中的离子.(1)按照实际操作先后顺序,指出从混合物中提取KCl的四个实验步骤:①溶解,②B,③C,④冷却结晶.(用序号填空)
A.溶解 B.过滤 C.蒸发 D.冷却结晶 E.萃取 F.分液 G.蒸馏
(2)完成步骤 ②实验操作,所选用的仪器为(用序号填空)ABEFG.
A.烧杯 B.玻璃棒 C.蒸发皿 D.酒精灯 E.普通漏斗F.滤纸 G.铁架台(带铁圈)
(3)步骤 ②③中都用到的玻璃仪器是玻璃棒;其在步骤③的作用是搅拌,使液体受热均匀,防止液滴飞溅.
(4)将制得的少量晶体放入试管,加水溶解,分装在两试管中.其一:用洁净的铂丝蘸取该无色溶液,放在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰颜色为紫色(填实验现象),证明有K+存在;其二先滴加几滴稀硝酸酸化,再加入4~6硝酸银溶液,有白色沉淀生成(填实验现象),证明有Cl一离子存在.写出该反应的化学方程式为KCl+AgNO3═AgCl↓+KNO3,该反应的类型为复分解(选填化合、分解、置换、复分解)反应.
分析 (1)从混合物中提取KCl,KCl溶于水,二氧化锰不溶于水,溶解、过滤可分离;
(2)步骤 ②为过滤操作;
(3)过滤中玻璃棒引流,蒸发中玻璃棒搅拌防止局部温度过高;
(4)观察K的焰色反应透过蓝色的钴玻璃,氯离子与硝酸银发生复分解反应生成白色沉淀,且不溶于硝酸.
解答 解:(1)KCl溶于水,二氧化锰不溶于水,从混合物中提取KCl的四个实验步骤:①溶解,②过滤,③蒸发,④冷却结晶,
故答案为:B; C;
(2)步骤 ②为过滤操作,需要的仪器为ABEFG,故答案为:ABEFG;
(3)步骤 ②③中都用到的玻璃仪器是玻璃棒;其在步骤③的作用是搅拌,使液体受热均匀,防止液滴飞溅,
故答案为:玻璃棒;搅拌,使液体受热均匀,防止液滴飞溅;
(4)将制得的少量晶体放入试管,加水溶解,分装在两试管中.其一:用洁净的铂丝蘸取该无色溶液,放在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰颜色为紫色,证明有K+存在;其二先滴加几滴稀硝酸酸化,再加入4~6硝酸银溶液,有白色沉淀生成,证明有Cl-离子存在.写出该反应的化学方程式为KCl+AgNO3═AgCl↓+KNO3,该反应的类型为复分解反应,
故答案为:透过蓝色钴玻璃观察,火焰颜色为紫色;白色沉淀生成;KCl+AgNO3═AgCl↓+KNO3;复分解.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法、离子检验等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | 等物质的量的SO2和Cl2相遇在溶液中具有漂白能力 |
5.某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
(1)他们能完成哪些因素对速率影响的探究?硝酸浓度、温度、大理石表面积.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
(3)整个实验中应控制的不变量是硝酸溶液体积和大理石质量.
(4)该实验小组用如图实验装置进行实验.
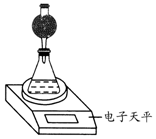
①除电子天平、干燥管、锥形瓶、药匙、胶塞、量筒等仪器外,必需的实验仪器还有秒表.
②干燥管中应放置的试剂是B.
A.碱石灰 B.无水CaCl2C.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
(1)他们能完成哪些因素对速率影响的探究?硝酸浓度、温度、大理石表面积.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 细颗粒 | 2.00 |
| ② | 常温 | 细颗粒 | 1.00 |
| ③ | 35℃ | 粗颗粒 | 2.00 |
| ④ | 35℃ | 细颗粒 | 2.00 |
(4)该实验小组用如图实验装置进行实验.

①除电子天平、干燥管、锥形瓶、药匙、胶塞、量筒等仪器外,必需的实验仪器还有秒表.
②干燥管中应放置的试剂是B.
A.碱石灰 B.无水CaCl2C.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
12.下列有关化学用语表示正确的是( )
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | B. | 16O与18O互为同位素 | ||
| C. | 氯离子的结构示意图: | D. | NaClO的电子式: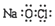 |
2.软锰矿(主要成分是MnO2)与过量KOH和KClO3固体在高温下反应,生成K2MnO4和KCl,其反应化学方程式为 MnO2+KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+KCl+H2O(未配平)下列说法中正确的是( )
| A. | 反应中MnO2是氧化剂 | |
| B. | 氧化产物与还原产物物质的量之比为1:3 | |
| C. | KClO3在反应中失去电子 | |
| D. | 反应中每生成l mol K2MnO4,氧化剂得到2 mol电子 |
9.下列说法正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| C. | NaHCO3溶液中溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| D. | 室温下,对于0.10 mol•L-1的氨水,加水稀释后,溶液中c(NH4+)•c(OH-)变大 |
6.化合物丙是制备液晶材料的中间体之一,它可由甲和乙在一定条件下制得
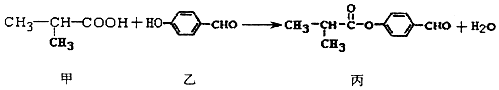
下列说法正确的是( )

下列说法正确的是( )
| A. | 丙的分子式为C11H11O3 | |
| B. | 甲分子中含有1个手性碳原子 | |
| C. | 乙、丙各lmol分别和氢气反应,最多消耗氢气均为4mol | |
| D. | 丙可发生加成反应、取代反应、氧化反应等 |
7.用石墨电极完成下列电解实验.下列对实验现象的解释或推测不合理的是( )
| 实验装置 | 实验现象 |
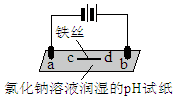 | a处试纸变蓝; b处变红,局部褪色; c处试纸变蓝; d处无明显变化 |
| A. | a为电解池的阴极 | |
| B. | b处有氯气生成,且与水反应生成了盐酸和次氯酸 | |
| C. | d处发生了反应:Fe-3e-=Fe3+ | |
| D. | c处:2H2O+2e-=H2↑+2OH- |
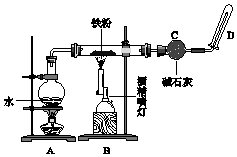 完成实验Fe与水蒸气反应,如图所示.
完成实验Fe与水蒸气反应,如图所示.