题目内容
14.实验室要配制100mL 2mol/L NaCl溶液,请回答下列问题:(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和100mL容量瓶.
(2)用托盘天平称取氯化钠固体,其质量为11.7 g.
(3)下列主要操作步骤的正确顺序是①③⑤②④(填序号).
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中.
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度偏低(填“偏高”或“偏低”或“无影响”,下同);若定容时俯视容量瓶刻度线,会造成所配溶液的物质的量浓度偏高.
分析 (1)依据用固体配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(2)依据m=CVM计算需要氯化钠的质量;
(3)依据用固体配制一定物质的量浓度溶液的一般步骤排序;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)用固体配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,配制100mL 2mol/L NaCl溶液,应选择100mL容量瓶,所以还缺少的仪器:100 mL容量瓶;
故答案为:100 mL容量瓶;
(2)配制100mL 2mol/L NaCl溶液,需要溶质的质量为:0.1L×2mol/L×58.5g/mol=11.7g;
故答案为:11.7;
(3)用固体配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,所以正确的操作步骤为:
①③⑤②④;
故答案为:①③⑤②④;
(4)如果实验过程中缺少步骤⑤,会造成部分溶质损耗,溶质的物质的量偏小,所配溶液的物质的量浓度 偏低;
若定容时俯视容量瓶刻度线,会造成所配溶液的体积偏小,溶液的物质的量浓度 偏高;
故答案为:偏低; 偏高.
点评 本题考查了一定物质的量浓度溶液的配制及误差分析,明确配制原理及操作步骤是解题关键,注意误差分析的方法.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
4.下列表述正确的是( )
| A. | 比例模型为 ,可以表示甲烷分子,也可以表示四氯化碳分子 ,可以表示甲烷分子,也可以表示四氯化碳分子 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 二氧化硫、氨、煤的液化均为物理变化 | |
| D. | 实验室中制取乙酸乙酯的方程式为CH3COOH+H18O-C2H5CH3COOC2H5+H218O |
5.某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
(1)他们能完成哪些因素对速率影响的探究?硝酸浓度、温度、大理石表面积.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
(3)整个实验中应控制的不变量是硝酸溶液体积和大理石质量.
(4)该实验小组用如图实验装置进行实验.
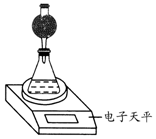
①除电子天平、干燥管、锥形瓶、药匙、胶塞、量筒等仪器外,必需的实验仪器还有秒表.
②干燥管中应放置的试剂是B.
A.碱石灰 B.无水CaCl2C.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
(1)他们能完成哪些因素对速率影响的探究?硝酸浓度、温度、大理石表面积.
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 细颗粒 | 2.00 |
| ② | 常温 | 细颗粒 | 1.00 |
| ③ | 35℃ | 粗颗粒 | 2.00 |
| ④ | 35℃ | 细颗粒 | 2.00 |
(4)该实验小组用如图实验装置进行实验.

①除电子天平、干燥管、锥形瓶、药匙、胶塞、量筒等仪器外,必需的实验仪器还有秒表.
②干燥管中应放置的试剂是B.
A.碱石灰 B.无水CaCl2C.浓硫酸
③若撤除干燥管装置,所测速率偏大(填“偏大”、“偏小”或“不变”).
2.软锰矿(主要成分是MnO2)与过量KOH和KClO3固体在高温下反应,生成K2MnO4和KCl,其反应化学方程式为 MnO2+KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+KCl+H2O(未配平)下列说法中正确的是( )
| A. | 反应中MnO2是氧化剂 | |
| B. | 氧化产物与还原产物物质的量之比为1:3 | |
| C. | KClO3在反应中失去电子 | |
| D. | 反应中每生成l mol K2MnO4,氧化剂得到2 mol电子 |
9.下列说法正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| C. | NaHCO3溶液中溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| D. | 室温下,对于0.10 mol•L-1的氨水,加水稀释后,溶液中c(NH4+)•c(OH-)变大 |
19.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 溴苯(溴单质) | 苯 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
6.化合物丙是制备液晶材料的中间体之一,它可由甲和乙在一定条件下制得
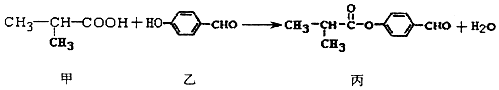
下列说法正确的是( )

下列说法正确的是( )
| A. | 丙的分子式为C11H11O3 | |
| B. | 甲分子中含有1个手性碳原子 | |
| C. | 乙、丙各lmol分别和氢气反应,最多消耗氢气均为4mol | |
| D. | 丙可发生加成反应、取代反应、氧化反应等 |
4.乙酸和乙醛的鉴别有多种方法,下列可行的操作中最不简便的一种是( )
| A. | 使用蒸馏水 | B. | 使用NaHCO3溶液 | ||
| C. | 使用CuSO4和NaOH溶液 | D. | 使用pH试纸 |
 NaHNa+[:H]- CsOH
NaHNa+[:H]- CsOH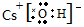 HSCN
HSCN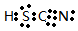 O22-
O22- .
.