题目内容
6.硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程图如下: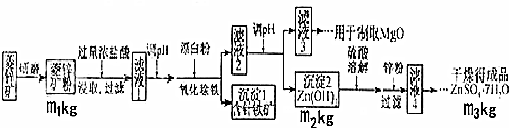
(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□1ClO-+□1H2O═□Fe(OH)3+□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,摩尔质量为89g.mol-1,化学式是FeO(OH).以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时针铁矿转化为Fe(OH)2,该电池放电反应的化学方程式是3FeO(OH)+Al+NaOH+H2O=NaAlO2+3Fe(OH)2
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4_.
| 沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.氨水
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125{m}_{2}}{81{m}_{1}}$×100%(用代数式表示)
分析 菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,加入过量浓盐酸溶解,过滤除去不溶物,滤液中含有氯化锌、氯化铁、氯化亚铁、氯化镁、氯化钙及为反应的HCl,加入漂白粉将二价铁氧化为三价铁,调节pH得到氢氧化铁沉淀,过滤分离后,再调节滤液pH得到Zn(OH)2沉淀,且不能生成Mg(OH)2.氢氧化锌用硫酸溶解,用Zn粉除去过量的硫酸,将溶液蒸发、结晶、过滤后洗涤并干燥得到晶体.
(1)根据影响化学反应速率的因素回答,固体表面积越大,反应速率越大;
(2)根据所加入物质的化学性质,根据质量守恒定律配平化学方程式;
(3)根据化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,来判断可能的组成;放电时NiO(OH)转化为Ni(OH)2,同时铝被氧化,因电解液呈碱性,则生成偏铝酸钠;
(4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH;
(5)从“滤液3”制取MgO过程中,应先生成Mg(OH)2;
(6)根据从溶液中制得干燥纯净的固体一般有蒸发、结晶、过滤后洗涤并干燥等操作来回答;
(7)利用关系式法来计算质量分数.
解答 解:(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使得反应更加充分,
故答案为:增大反应物接触面积或增大反应速率或使反应更充分;
(2)流程中“氧化除铁”是加入漂白粉,方程式后面产物中又有氯离子,可知氧化剂是ClO-,观察方程式前后可以推出还要加入水分子,配平书写得到离子方程式为:2Fe(OH)2+ClO-+H2O═2Fe(OH)3+Cl-,
故答案为:2,1ClO-,1H2O,2,1;
(3)化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH),放电时NiO(OH)转化为Ni(OH)2,同时铝被氧化,因电解液呈碱性,则生成偏铝酸钠,反应的总方程式为Al+3NiO(OH)+NaOH+H2O═NaAlO2+3Ni(OH)2,
故答案为:FeO(OH);Al+3NiO(OH)+NaOH+H2O═NaAlO2+3Ni(OH)2.
(4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH,pH应介于8.0≤pH<10.4,
故答案为:8.0≤pH<10.4;
(5)从“滤液3”制取MgO过程中,应先生成Mg(OH)2,溶液碱性应较强,bd符合,而纯碱溶液水解呈碱性,碱性较弱,故答案为:bd;
(6)“滤液4”之后的操作目的是得到纯净的固体,应将溶液蒸发、结晶、过滤后洗涤并干燥,故答案为:蒸发浓缩、冷却结晶;
(7)设碳酸锌的质量为m,利用关系式法计算:
ZnCO3----ZnO
125 81
m m2
ZnCO3 的质量为m=$\frac{125{m}_{2}}{81}$,
ZnCO3 的质量分数为$\frac{125{m}_{2}}{81{m}_{1}}$×100%,
故答案为:$\frac{125{m}_{2}}{81{m}_{1}}$×100%.
点评 本题是流行的化工工艺流程题,主要依据流程图中涉及的化学知识、化学原理来设计问题.能够将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题,主要是物质分离提纯的过程分析判断,题目难度中等.

| 选项 | 要鉴别的物质组 | 试剂 | 方法 |
| A | NaCl/Na2CO3 | BaCl2溶液 | 观察是否产生沉淀 |
| B | NO2/Br2 | 湿润的淀粉碘化钾试纸 | 观察试纸是否变蓝色 |
| C | 乙醇/乙酸 | 新制氢氧化铜悬浊液 | 观察溶液是否变澄清 |
| D | CO2/SO2 | 品红溶液 | 观察溶液红色是否退去 |
| A. | A | B. | B | C. | C | D. | D |
实 验 报 告
(一)实验目的:探究钠及其化合物的有关性质
(二)实验药品及仪器:金属钠,蒸馏水,酒精灯,试管,木条,石棉网,铁架台
(三)实验过程:
| 实验步骤 | 实验现象 | 化学方程式或结论 |
| 金属Na长时间放置在空气中 | 银白色的金属光泽消失,迅速变暗,有水珠生成,最终生成白色的粉末 | ①4Na+O2═2Na2O Na2O+H2O═2NaOH 2Na+2H2O═2NaOH+H2↑ 2NaOH+CO2═Na2CO3+H2O |
| 将一块Na置于石棉网上,点燃酒精灯加热 | 钠先熔成小球,剧烈燃烧并发出黄色的火焰,生成②淡黄色色的粉末 | 2Na+O2 ═Na2O2 |
| 往上述生成的 Na2O2上滴加蒸馏水 | 生成的气体能使带火星的木条复燃 | 该气体为③O2 |
(1)钠的化学性质活泼,在自然界中全部以化合态形态(填“游离态”或“化合态”)存在,因此少量钠应保存在煤油中.
(2)写出Na2O2的一种用途:作供氧剂或利用强氧化性杀菌消毒.
| A. | C->D2->A+>B2+ | B. | B2+>A+>C->D2- | C. | B2+>A+>D2->C- | D. | D2->C->A+>B2+ |
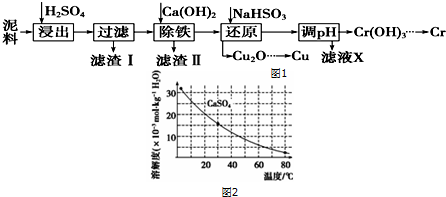
已知部分物质沉淀的pH如下表,CaSO4的溶解度曲线如图2:
| 物质 | Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围是3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].
| A. | 用澄清石灰水鉴别CO2和SO2 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用CO2鉴别NaAlO2溶液和NaClO溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 |
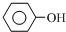 +3Br2→
+3Br2→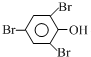 ↓+3HBr
↓+3HBr