题目内容
6.氮族元素(Nitrogen group)是元素周期表ⅤA族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和Uup共计六种.(1)氮族元素的外围电子排布式的通式为ns2np3;基态磷原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(2)PH3分子的VSEPR模型为四面体形,键角NH3>H2O(填“>”、“<”或“=”).
(3)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子中氮的杂化方式为sp.
(4)从化合物NF3和NH3的结构与性质关系比较,回答它们两者如下性质差异原因:
①NF3的沸点为-129℃,而NH3的沸点为-33℃,其原因是NH3能形成氢键,NF3只有范德华力.
②NH3易与Cu2+反应,而NF3却不能,其原因是F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子.
(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层,磷化硼晶体的晶胞结构与金刚石类似,磷原子作面心立方最密堆积,则磷原子的配位数为4;已知磷化硼的晶胞边长a=478pm,计算晶体中硼原子和磷原子的核间距(dB-P)=207pm(保留三位有效数字)
分析 (1)氮族元素的外围电子为其最外层上s、p能级电子;
基态磷原子中,电子占据的最高能层符号为M,该能层有1个s轨道、3个p轨道、5个d轨道;
(2)PH3分子中P原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的VSEPR模型,成键电子对和孤电子对之间的排斥力小于孤电子对之间的排斥力,据此判断键角;
(3)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为$\frac{5-1}{2}$=2,根据价层电子对互斥理论判断原子杂化方式;
(4)①分子晶体中含有氢键的物质熔沸点较高;
②NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(5)磷化硼结构如图所示 ,该晶胞中B原子为4个、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个P原子连接4个B原子,则磷原子的配位数为4;晶体中硼原子和磷原子的核间距(dB-P)等该晶胞体对角线的$\frac{1}{4}$,据此计算.
,该晶胞中B原子为4个、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个P原子连接4个B原子,则磷原子的配位数为4;晶体中硼原子和磷原子的核间距(dB-P)等该晶胞体对角线的$\frac{1}{4}$,据此计算.
解答 解:(1)氮族元素的外围电子为其最外层上s、p能级电子,则氮族元素外围电子排布式为ns2np3;
基态磷原子中,电子占据的最高能层符号为M,该能层有1个s轨道、3个p轨道、5个d轨道,所以有9个轨道,
故答案为:ns2np3;M;9;
(2)PH3分子中P原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断该分子的VSEPR模型为四面体形,成键电子对和孤电子对之间的排斥力小于孤电子对之间的排斥力,氨气分子中只含一个孤电子对、水分子中含有两个孤电子对,所以键角,故答案为:四面体形;>;
(3)氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心原子价电子对数为$\frac{5-1}{2}$=2,根据价层电子对互斥理论判断原子杂化方式为sp,
故答案为:sp;
(4)①NH3存在氢键,而NF3只存在分子间作用力,两种作用力前者较强,物质的沸点较高,
故答案为:NH3能形成氢键,NF3只有范德华力;
②F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子,所以NF3不易与Cu2+形成配离子,
故答案为:F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(5)磷化硼结构如图所示 ,该晶胞中B原子为4个、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个P原子连接4个B原子,则磷原子的配位数为4;晶体中硼原子和磷原子的核间距(dB-P)等该晶胞体对角线的$\frac{1}{4}$=$\frac{1}{4}$×$\sqrt{3}$a=$\frac{1}{4}$×$\sqrt{3}$×478pm=207pm,
,该晶胞中B原子为4个、P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个P原子连接4个B原子,则磷原子的配位数为4;晶体中硼原子和磷原子的核间距(dB-P)等该晶胞体对角线的$\frac{1}{4}$=$\frac{1}{4}$×$\sqrt{3}$a=$\frac{1}{4}$×$\sqrt{3}$×478pm=207pm,
故答案为:207.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、氢键、键角、微粒空间构型、原子核外电子排布等知识点,侧重考查学生知识应用、计算、空间想象能力,难点是晶胞计算,注意该晶胞中B-P原子核间距与体长关系,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 原电池是将化学能转化为电能的装置 | |
| B. | 原电池负极发生氧化反应 | |
| C. | 原电池中,阳离子向负极移动 | |
| D. | 原电池电子流出的一极为负极 |
| A. | 硒化氢的稳定性比水的弱 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 硒的氧化性比硫的强 | |
| D. | 硒的最高价氧化物对应的水化物酸性比砷的强 |
 >H2CO3>
>H2CO3> ,将
,将  转变为
转变为 的方法是( )
的方法是( )| A. | 与足量的NaOH溶液共热,再通入CO2 | |
| B. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| C. | 加热溶液,通入足量的CO2 | |
| D. | 与稀H2SO4共热后,加入足量的NaHCO3溶液 |
| A. | 无色溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀,则溶液中一定含有SO42- | |
| B. | 用加热法可除去NaHCO3中少量的Na2CO3 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 酸碱中和滴定时,锥形瓶需用待测液润洗后,再加入待测液 |
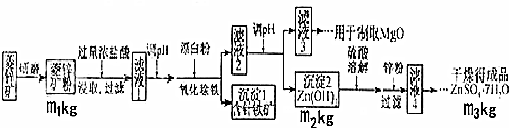
(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□1ClO-+□1H2O═□Fe(OH)3+□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,摩尔质量为89g.mol-1,化学式是FeO(OH).以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时针铁矿转化为Fe(OH)2,该电池放电反应的化学方程式是3FeO(OH)+Al+NaOH+H2O=NaAlO2+3Fe(OH)2
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4_.
| 沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.氨水
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125{m}_{2}}{81{m}_{1}}$×100%(用代数式表示)
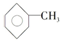 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 ,表示的分子式C6H14名称是2-甲基戊烷
,表示的分子式C6H14名称是2-甲基戊烷 .
.