题目内容
11.某兴趣小组拟采用萃取法从富马酸废液中回收易挥发的Br2,方案如下: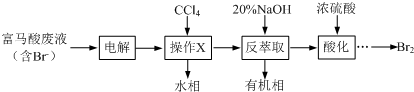
(1)操作X所需要的主要玻璃仪器为分液漏斗;反萃取时加入20%的NaOH溶液,其离子方程式为Br2+2OH-=Br-+BrO-+H2O.
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是减少Br2的挥发.
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出.与传统工艺相比,萃取法的优点是没有采用有毒气体Cl2,更环保.
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L.实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
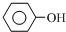 +3Br2→
+3Br2→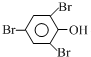 ↓+3HBr
↓+3HBr①请补充完整相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中.
步骤2:将4.5mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡.
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡.
步骤4:滴入2~3滴淀粉溶液,再用0.01mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15mL.(反应原理:I2+2Na2S2O3═2NaI+Na2S4O6)
步骤5:将实验步骤1~4重复2次.
②该废水中苯酚的含量为18,8mg/L.
③步骤3若持续时间较长,则测得的废水中苯酚的含量偏低(填“偏高”、“偏低”或“无影响”).
分析 富马酸废液中含有Br-,电解生成溴单质,加入四氯化碳萃取后分液,再加入氢氧化钠反萃取得到含修炼者和次溴酸根离子的溶液,加入硫酸酸化发生氧化还原反应生成溴单质,
(1)操作X为萃取分液,需要烧杯、分液漏斗等仪器;反萃取时加入20%的NaOH溶液反应生成溴化钠、次溴酸钠和水;
(2)溴单质易挥发,浓硫酸溶解放热分析;
(3)无有毒气体氯气参加反应,生产过程环保;
(4)①硫代硫酸钠溶液滴定碘单质,加入淀粉溶液做指示剂;
②依据化学方程式定量关系计算;
③步骤3持续的时间长导致的是KI被氧化.
解答 解:富马酸废液中含有Br-,电解生成溴单质,加入四氯化碳萃取后分液,再加入氢氧化钠反萃取得到含修炼者和次溴酸根离子的溶液,加入硫酸酸化发生氧化还原反应生成溴单质,
(1)操作X为萃取分液,需要烧杯、分液漏斗等仪器;反萃取时加入20%的NaOH溶液反应生成溴化钠、次溴酸钠和水,反应的离子方程式为:Br2+2OH-=Br-+BrO-+H2O;
故答案为:分液漏斗,Br2+2OH-=Br-+BrO-+H2O;
(2)溴单质易挥发,浓硫酸溶解放热分析,反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是减少溴单质的挥发;
故答案为:减少Br2的挥发;
(3)无有毒气体氯气参加反应,生产过程环保;
故答案为:没有采用有毒气体Cl2,更环保;
(4)①硫代硫酸钠溶液滴定碘单质,加入淀粉溶液做指示剂;滴入2~3滴淀粉溶液,再用0.01mol/L Na2S2O3标准溶液滴定至终点;
故答案为;滴入2~3滴淀粉溶液;
②依据化学方程式定量关系计算,将4.5mL 0.02mol/L溴水迅速加入到锥形瓶中,n(Br2)=0.0045L×0.02mol/L=0.00009mol,其中和碘化钾反应的溴单质物质的量
2KI~Br2~I2~2Na2S2O3,;
1 2
n 0.01mol/L×0.015L
n=0.000075mol
与苯酚反应的溴单质=0.00009mol-0.000075mol=0.000015mol
则苯酚物质的量=$\frac{1}{3}$×0.000015mol=0.000005mol
该废水中苯酚的含量为=$\frac{1000ml}{25ml}$×0.000005mol×94g/mol=0.0188g/L=18.8mg/L,
故答案为:18,8;
③步骤3持续的时间长导致的是KI被氧化,测定苯酚量减少,测定结果偏低;
故答案为:偏低.
点评 本题考查了废水中物质含量的测定实验探究和物质性质的分析判断,注意滴定实验的过程分析应用,掌握基础是关键,题目难度中等.

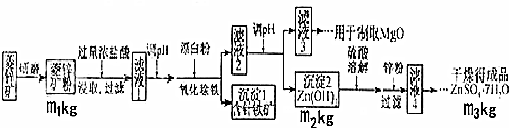
(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□1ClO-+□1H2O═□Fe(OH)3+□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,摩尔质量为89g.mol-1,化学式是FeO(OH).以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时针铁矿转化为Fe(OH)2,该电池放电反应的化学方程式是3FeO(OH)+Al+NaOH+H2O=NaAlO2+3Fe(OH)2
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4_.
| 沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.氨水
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125{m}_{2}}{81{m}_{1}}$×100%(用代数式表示)
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的状态 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m2 |
| 3 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| 4 | 50.0 | 6.0 | 粉末 | 25 | t2 | 14.9 |
| 5 | 50.0 | 8.0 | 粉末 | 25 | t3 | 19.3 |
| 6 | 50.0 | 10.0 | 粉末 | 25 | t4 | m3 |
| A. | t1>70 | |
| B. | m3=19.3 | |
| C. | 实验1、实验2与实验3探究的是温度对化学反应速率的影响 | |
| D. | 无法计算出硫酸的物质的量浓度 |
| A. | NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心 | |
| B. | CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心 | |
| C. | H2O是极性分子,分子中O原子和2个H原子不在一条直线上 | |
| D. | CO2是非极性分子,分子中C原子和2个O原子不在一条直线上 |
| A. | 铁易生锈 | B. | 用金属铝制成导线 | ||
| C. | 用金箔做外包装 | D. | 用铁制品做炊具 |
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题: