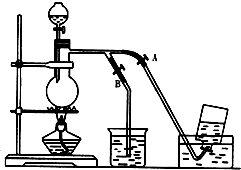
题目内容
18.A+、B2+、C-、D2- 四种离子核外电子排布相同,则这四种离子半径大小顺序是( )| A. | C->D2->A+>B2+ | B. | B2+>A+>C->D2- | C. | B2+>A+>D2->C- | D. | D2->C->A+>B2+ |
分析 四种离子核外电子排布相同,所以核外的电子数是一样的,阳离子的质子数大于阴离子的核内质子数,阳离子带的电荷数越多,质子数越大,阴离子带的电荷数越多,质子数越小,核外电子一样多,质子数越大,半径越小.
解答 解:四种离子核外电子排布相同,所以核外的电子数是一样的,阳离子的质子数大于阴离子的核内质子数,阳离子带的电荷数越多,质子数越大,阴离子带的电荷数越多,质子数越小,核外电子一样多,质子数越大,半径越小,所以四种离子半径大小顺序是D2->C->A+>B2+,故选D.
点评 本题考查微粒半径大小比较知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握微粒结构特点是关键.

练习册系列答案
相关题目
17.“北大富硒康”中含有微量元素硒(Se),对人体有保健作用.已知硒为第四周期第ⅥA族元素,根据它在周期表中的位置推测,硒不可能具有的性质是( )
| A. | 硒化氢的稳定性比水的弱 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 硒的氧化性比硫的强 | |
| D. | 硒的最高价氧化物对应的水化物酸性比砷的强 |
18.下列说法正确的是( )
| A. | 无色溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀,则溶液中一定含有SO42- | |
| B. | 用加热法可除去NaHCO3中少量的Na2CO3 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 酸碱中和滴定时,锥形瓶需用待测液润洗后,再加入待测液 |
6.硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程图如下:
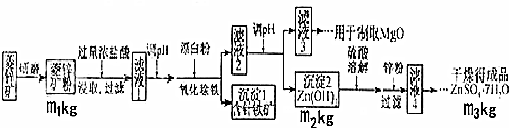
(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□1ClO-+□1H2O═□Fe(OH)3+□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,摩尔质量为89g.mol-1,化学式是FeO(OH).以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时针铁矿转化为Fe(OH)2,该电池放电反应的化学方程式是3FeO(OH)+Al+NaOH+H2O=NaAlO2+3Fe(OH)2
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4_.
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是bd(选填序号).
a.大理石粉 b.石灰乳 c.纯碱溶液 d.氨水
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125{m}_{2}}{81{m}_{1}}$×100%(用代数式表示)

(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□1ClO-+□1H2O═□Fe(OH)3+□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,摩尔质量为89g.mol-1,化学式是FeO(OH).以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时针铁矿转化为Fe(OH)2,该电池放电反应的化学方程式是3FeO(OH)+Al+NaOH+H2O=NaAlO2+3Fe(OH)2
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4_.
| 沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.氨水
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125{m}_{2}}{81{m}_{1}}$×100%(用代数式表示)
13.下列说法中,正确的是( )
| A. | 卤代烃在NaOH的醇溶液中共热均能发生消去反应生成烯烃 | |
| B. | 凡是能发生银镜反应的物质都属于醛类 | |
| C. | 能与FeCl3溶液作用显紫色的有机物一般含有酚羟基 | |
| D. | 酯类水解均能生成含相同碳原子数的羧酸和醇 |
10.下列反应离子方程式书写不正确的是( )
| A. | 硝酸银与氯化钾溶液的反应:Ag++Cl-═AgCl↓ | |
| B. | 硝酸与氢氧化钠溶液的反应:H++OH-═H2O | |
| C. | 碳酸钙与盐酸的反应:CO32-+2H+═CO2↑+H2O | |
| D. | 锌粒与稀硫酸的反应:Zn+2H+═Zn2++H2↑ |
7.苯分子中的一个氢原子被一个甲基取代后的产物叫甲苯 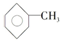 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
8.下列有关实验的说法正确的是( )
| A. | 向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 | |
| B. | 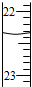 滴定达终点时,如图滴定管的正确读数为23.65 mL | |
| C. | 25℃时,在Mg(OH)2悬浊液中加入少量NH4Cl固体后,c(Mg2+)增大 | |
| D. | 测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |