题目内容
15.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如图1: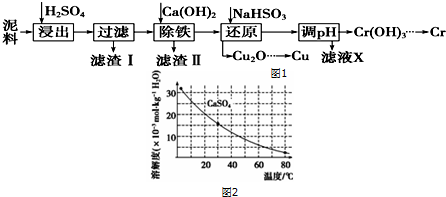
已知部分物质沉淀的pH如下表,CaSO4的溶解度曲线如图2:
| 物质 | Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围是3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].
分析 (1)根据氧化铜和硫酸反应生成硫酸铜和水进行解答,向电镀污泥中加入硫酸,氧化铁、CuO、Cr2O3都与硫酸反应生成硫酸铁、硫酸铜和硫酸铬;
(2)根据图表可知铁离子完全沉淀pH为3.2,Cr3+开始沉淀PH=4.3,所以在除铁操作中,需要除去Fe3+和CaSO4,硫酸钙溶解度随升高温度减小,易于除去;
(3)亚硫酸氢根离子具有强的还原性,能和铜离子之间发生反应生成硫酸根离子以及氧化亚铜,过量的碳酸氢根离子和酸反应会生成二氧化硫气体;
(4)根据Ksp[Cr(OH)3]=c(Cr3+)•(OH-)3来计算回答.
解答 解:(1)向电镀污泥中加入硫酸,氧化铁、CuO、Cr2O3都与硫酸反应生成硫酸铁、硫酸铜和硫酸铬,滤渣Ⅰ是难溶杂质,氧化铜和硫酸反应生成硫酸铜和水,所以在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有硫酸铜,
故答案为:CuSO4;
(2)根据图表可知铁离子完全沉淀pH为3.2,Cr3+开始沉淀PH=4.3,所以在除铁操作中,需要除去Fe3+和CaSO4,相关操作:
①加入石灰乳调节pH到3.2~4.3,检验Fe3+已经除尽的操作是:取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除,
故答案为:3.2~4.3;取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80,为避免溶质损失,硫酸钙溶解度随温度升高减小,需要趁热过滤,
故答案为:趁热过滤;
(3)硫酸氢根离子具有强的还原性,能和铜离子之间发生反应生成硫酸根离子以及氧化亚铜,发生的反应为:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,在酸性环境下,亚硫酸氢根离子和氢离子之间反应生成的二氧化硫具有毒性,能污染空气,
故答案为:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+;产生SO2污染环境;
(4)当离子浓度≤1×10-5 mol•L-1认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥$\root{3}{\frac{Ksp}{c(C{r}^{3+})}}$=$\root{3}{\frac{6.3×1{0}^{-31}}{1×1{0}^{-5}}}$=4.0×10-9 mol•L-1,
故答案为:4.0×10-9 mol•L-1.
点评 本题考查了离子方程式的书写、物质的分离等知识点,题目难度中等,注意会运用溶液的pH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.

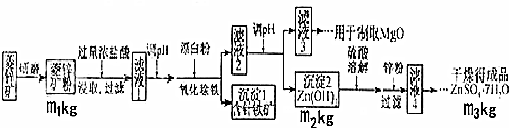
(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□1ClO-+□1H2O═□Fe(OH)3+□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,摩尔质量为89g.mol-1,化学式是FeO(OH).以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时针铁矿转化为Fe(OH)2,该电池放电反应的化学方程式是3FeO(OH)+Al+NaOH+H2O=NaAlO2+3Fe(OH)2
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4_.
| 沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.氨水
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125{m}_{2}}{81{m}_{1}}$×100%(用代数式表示)
| A. | 硝酸银与氯化钾溶液的反应:Ag++Cl-═AgCl↓ | |
| B. | 硝酸与氢氧化钠溶液的反应:H++OH-═H2O | |
| C. | 碳酸钙与盐酸的反应:CO32-+2H+═CO2↑+H2O | |
| D. | 锌粒与稀硫酸的反应:Zn+2H+═Zn2++H2↑ |
| A. | NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心 | |
| B. | CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心 | |
| C. | H2O是极性分子,分子中O原子和2个H原子不在一条直线上 | |
| D. | CO2是非极性分子,分子中C原子和2个O原子不在一条直线上 |
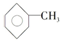 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属元素是钾,形成化合物种类最多的元素是碳(填写元素名称).
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;Al(OH)3+KOH=KAlO2+2H2O.
(4)证明元素⑥、⑦非金属性强弱,用一个化学方程式表示:Cl2+Na2S═2NaCl+S↓.
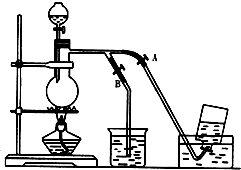
(1)上述实验中发生反应的离子方程式有:Zn+2H+═Zn2++H2↑、Zn+Cu2+═Zn2++Cu;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn-稀硫酸原电池,加快了氢气产生的速率;
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度、增加锌粒的表面积等(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈暗红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积,使得生成氢气的速率下降.
④实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率ν(H2SO4)=0.01mol/(L•min)(忽略反应前后溶液体积变化).
 ,表示的分子式C6H14名称是2-甲基戊烷
,表示的分子式C6H14名称是2-甲基戊烷 .
.