题目内容
3.鉴别下列各组物质,选用的试剂或方法错误的是( )| 选项 | 要鉴别的物质组 | 试剂 | 方法 |
| A | NaCl/Na2CO3 | BaCl2溶液 | 观察是否产生沉淀 |
| B | NO2/Br2 | 湿润的淀粉碘化钾试纸 | 观察试纸是否变蓝色 |
| C | 乙醇/乙酸 | 新制氢氧化铜悬浊液 | 观察溶液是否变澄清 |
| D | CO2/SO2 | 品红溶液 | 观察溶液红色是否退去 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化钠不与氯化钡反应,碳酸钠能够与氯化钡溶液反应生成碳酸钡沉淀;
B.二氧化氮和溴单质都具有氧化性,都能够使湿润的淀粉碘化钾试纸变蓝;
C.乙酸能够与氢氧化铜反应,使浊液变澄清;
D.二氧化硫具有漂白性,能够使品红溶液褪色.
解答 解:A.鉴别NaCl和Na2CO3,可用BaCl2溶液,前者无明显现象,后者生成白色沉淀,故A正确;
B.NO2、Br2都能够使湿润的淀粉碘化钾试纸变蓝,不能用湿润的淀粉碘化钾试纸检验二氧化氮和溴,故B错误;
C.乙醇不与氢氧化铜浊液反应,而乙酸与氢氧化铜反应,从而使氢氧化铜浊液变澄清,可用新制氢氧化铜浊液检验乙醇和乙酸,故C正确;
D.鉴别CO2、SO2,可用品红溶液,前者无明显现象,后者具有漂白性,能够使品红溶液褪色,故D正确;
故选B.
点评 本题考查了性质方案设计与评价,题目难度中等,明确常见物质性质及检验方法为解答关键,注意熟练掌握常见元素及其化合物性质,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 无色溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀,则溶液中一定含有SO42- | |
| B. | 用加热法可除去NaHCO3中少量的Na2CO3 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 酸碱中和滴定时,锥形瓶需用待测液润洗后,再加入待测液 |
6.硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程图如下:
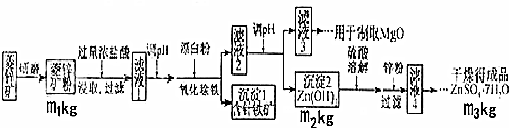
(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□1ClO-+□1H2O═□Fe(OH)3+□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,摩尔质量为89g.mol-1,化学式是FeO(OH).以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时针铁矿转化为Fe(OH)2,该电池放电反应的化学方程式是3FeO(OH)+Al+NaOH+H2O=NaAlO2+3Fe(OH)2
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4_.
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是bd(选填序号).
a.大理石粉 b.石灰乳 c.纯碱溶液 d.氨水
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125{m}_{2}}{81{m}_{1}}$×100%(用代数式表示)

(1)将菱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分.
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□1ClO-+□1H2O═□Fe(OH)3+□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,摩尔质量为89g.mol-1,化学式是FeO(OH).以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时针铁矿转化为Fe(OH)2,该电池放电反应的化学方程式是3FeO(OH)+Al+NaOH+H2O=NaAlO2+3Fe(OH)2
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4_.
| 沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.氨水
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤,洗涤,干燥.
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于$\frac{125{m}_{2}}{81{m}_{1}}$×100%(用代数式表示)
4.下表为元素周期表的一部分,请回答有关问题
(1)⑤和⑧的元素符号是Si和Ar.
(2)表中最活泼的金属元素是钾,形成化合物种类最多的元素是碳(填写元素名称).
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;Al(OH)3+KOH=KAlO2+2H2O.
(4)证明元素⑥、⑦非金属性强弱,用一个化学方程式表示:Cl2+Na2S═2NaCl+S↓.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属元素是钾,形成化合物种类最多的元素是碳(填写元素名称).
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;Al(OH)3+KOH=KAlO2+2H2O.
(4)证明元素⑥、⑦非金属性强弱,用一个化学方程式表示:Cl2+Na2S═2NaCl+S↓.
 ,表示的分子式C6H14名称是2-甲基戊烷
,表示的分子式C6H14名称是2-甲基戊烷 .
.