题目内容
14.常温下,1mol化学键分解成气态原子所需要的能量用E表示.结合表中信息判断下列说法不正确的是( )| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1 ) | 436 | 157 | 568 | 432 | 298 |
| A. | 432 kJ•mol -1>E(H-Br)>298 kJ•mol -1 | |
| B. | 表中最稳定的共价键是H-F键 | |
| C. | H 2 (g)→2H (g)△H=+436 kJ•mol -1 | |
| D. | H 2 (g)+F 2 (g)=2HF(g)△H=-25 kJ•mol -1 |
分析 A.依据溴原子半径大于氯原子小于碘原子,半径越大键能越小分析推断;
B.键能越大形成的化学键越稳定;
C.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量;
D.依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断.
解答 解:A.依据溴原子半径大于氯原子小于碘原子,半径越大键能越小分析,所以结合图表中数据可知432 kJ•mol-1>E(H-Br)>298 kJ•mol-1,故A正确;
B.键能越大形成的化学键越稳定,表中键能最大的是H-F,最稳定的共价键是H-F键,故B正确;
C.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量,H2(g)→2H (g)?△H=+436 kJ•mol-1 ,故C正确;
D.依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断,△H=436KJ/mol+157KJ/mol-2×568KJ/mol=-543KJ/mol,H2(g)+F2(g)=2HF(g)?△H=-543 kJ•mol-1,故D错误;
故选D.
点评 本题考查了化学反应能量变化和键能的关系分析判断,焓变计算方法是解题关键,题目难度中等.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
4.除去下列物质中所含少量杂质(括号内为杂质),所选的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 苯(甲苯) | 酸性高锰酸钾溶液 NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
5.某同学用15mol•L-1浓硫酸,按下列步骤配2505mL0.1mol•L-1H2SO4溶液,请回答有关问题.
(1)本实验不需要用到的仪器是c
a.玻璃棒 b.烧杯 c.天平 d胶头滴管
(2)在进行④步操作时,不慎将溶液溅到容量瓶外,则配制溶液的浓度将偏低(填写偏高、偏低、不影响.下同).若配制时容量瓶没有干燥,则配制溶液浓度将不影响.
(3)某研究人员应用如图研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸汽.请回答下列问题:
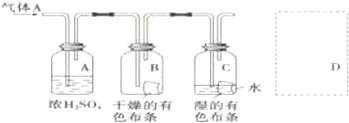
①浓硫酸的作用是干燥剂.
②通入Cl2后,从集气瓶B中干燥的有色布条的现象可得出的结论是干燥氯气不具有漂白性从集气瓶C中湿润的有色布条的现象可得出的结论是次氯酸具有漂白性.
③从物质性质的方面来看,这样的实验设计还存在事故隐患,请在图D处以图的形式表明克服事故隐患的措施.
| 实验步骤 | 有关问题 |
| (1)计算所需浓硫酸的体积 | 需取浓硫酸(1.7)mL |
| (2)量 取浓硫酸 | 需要用到的主要仪器是:5mL量筒 |
| (3)将 浓硫酸沿着玻璃棒缓缓注入盛有水的烧杯中并搅拌 | 该操作要做到胆大心细,杜绝事故发生 |
| (4)待溶液冷却至室温,将烧杯中溶液转移至250mL容量瓶中 | 要注意把洗涤液一并转移至容量瓶中 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2cm处后的正确操作是:改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切 |
a.玻璃棒 b.烧杯 c.天平 d胶头滴管
(2)在进行④步操作时,不慎将溶液溅到容量瓶外,则配制溶液的浓度将偏低(填写偏高、偏低、不影响.下同).若配制时容量瓶没有干燥,则配制溶液浓度将不影响.
(3)某研究人员应用如图研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸汽.请回答下列问题:

①浓硫酸的作用是干燥剂.
②通入Cl2后,从集气瓶B中干燥的有色布条的现象可得出的结论是干燥氯气不具有漂白性从集气瓶C中湿润的有色布条的现象可得出的结论是次氯酸具有漂白性.
③从物质性质的方面来看,这样的实验设计还存在事故隐患,请在图D处以图的形式表明克服事故隐患的措施.
2.同周期的X、Y、Z三元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
| A. | 原子半径:X>Y>Z | |
| B. | 非金属性:X>Y>Z | |
| C. | 阴离子的还原性按X、Y、Z的顺序由强到弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
19.在0.1mol•L-1NH3•H2O溶液中存在如下电离平衡:NH3•H2O?NH4++OH-.对于该平衡,下列叙述中正确的是( )
| A. | 降低温度,溶液中c(NH4+)增大 | |
| B. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ 增大 | |
| C. | 加入水时,溶液中c(H+)减小 | |
| D. | 加入少量NaOH固体,平衡向逆反应方向移动,溶液中c(OH-)减小 |
 .
.