题目内容
4.除去下列物质中所含少量杂质(括号内为杂质),所选的试剂和分离方法能达到实验目的是( )| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 苯(甲苯) | 酸性高锰酸钾溶液 NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溴、三溴苯酚均易溶于苯;
B.乙烯被高锰酸钾氧化生成二氧化碳;
C.二者均与NaOH溶液反应;
D.甲苯被高锰酸钾氧化后,与苯分层.
解答 解:A.溴、三溴苯酚均易溶于苯,不能除杂,应选NaOH溶液、分液,故A错误;
B.乙烯被高锰酸钾氧化生成二氧化碳,不能除杂,应选溴水、洗气,故B错误;
C.二者均与NaOH溶液反应,不能除杂,应选饱和碳酸钠溶液、分液,故C错误;
D.甲苯被高锰酸钾氧化后,与苯分层,然后分液可除杂,故D正确;
故选D.
点评 本题考查混合物分离提纯,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的性质、性质差异及混合物分离方法选择为解答该类题目的关键,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
12.下列离子在水溶液中能大量共存的是( )
| A. | Cl-、K+、HCO3-、Ca2+ | B. | OH-、NH4+、Mg2+、HCO3- | ||
| C. | SO32-、H+、Cl-、NO3- | D. | Na+、SiO32-、H+、Cl- |
19.下列实验现象及结论正确的是( )
| A. | 向AgNO3溶液中加入几滴NaCl溶液生成白色沉淀,再向试管内加入KI溶液若生成黄色沉淀,则证明KSP(AgCl)>KSP(AgI) | |
| B. | Na2CO3溶液滴入硼酸溶液中,无气泡生成,说明Ka:H2CO3>H3BO3 | |
| C. | 等物质的量浓度、等体积的CH3COONa和NaClO阴离子的总数前者小于后者 | |
| D. | 若弱酸的酸性H2A>H2B>HA->HB-,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者大于后者 |
9.下列各组离子在指定条件下,一定不能大量共存的是( )
| A. | 加入Al能放出H2的溶液中:K+、Na+、CO32-、NO3- | |
| B. | 滴入甲基橙变黄的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br- | |
| D. | 水电离出的c(H+)=1×10-12 mol•L-1的溶液中:Na+、Mg2+、Cl-、SO42- |
16.下列说法正确的是( )
| A. | 所有需要加热的反应都是吸热反应 | |
| B. | 所有金属元素形成的化合物都是离子化合物 | |
| C. | 所有主族元素的族序数等于其原子最外层上的电子数 | |
| D. | 所有共价化合物分子中每个原子最外层都达到稀有气体的稳定结构 |
14.常温下,1mol化学键分解成气态原子所需要的能量用E表示.结合表中信息判断下列说法不正确的是( )
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1 ) | 436 | 157 | 568 | 432 | 298 |
| A. | 432 kJ•mol -1>E(H-Br)>298 kJ•mol -1 | |
| B. | 表中最稳定的共价键是H-F键 | |
| C. | H 2 (g)→2H (g)△H=+436 kJ•mol -1 | |
| D. | H 2 (g)+F 2 (g)=2HF(g)△H=-25 kJ•mol -1 |
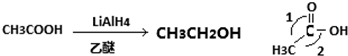
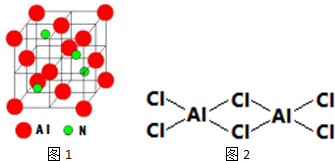
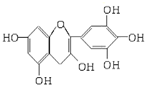 茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( ) .
.