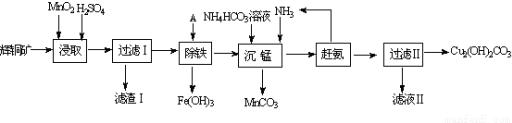
题目内容
4.已知A、B、C、D是1~18号元素中的四种,0.5molA元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100mL0.2mol/L的盐酸完全反应,A原子核内质子数与中子数相等.B是地壳中含量最多的金属元素.C得到一个电子后与氩的电子层结构相同,其最高价氧化物的水化物为自然界最强的酸.D元素是构成有机物的主要元素,其最外层电子数是最内层电子数的2倍.(1)写出下列元素的名称:B铝C氯
(2)元素D 在周期表中的位置是第二周期ⅣA族.
(3)元素A的原子结构示意图为
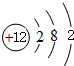 .
.(4)A的单质可在D的最高价氧化物中燃烧得到一种白色固体和一种黑色固体,试写出其化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)C的单质可用于生产漂白粉,该反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(6)向10mL浓度为1mol/L的B、C两元素形成的化合物的水溶液里逐滴滴入35mL浓度为1mol/L的苛性钠溶液,现象是先生成白色沉淀,后白色沉淀部分溶解.
分析 短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A离子为带两个单位正电荷的阳离子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由AO+2HCl═ACl2+H2O,M(AO)=$\frac{0.4g}{0.01mol/L}$=40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B是地壳中含量最多的金属元素,则B为Al.C得到一个电子后与氩的电子层结构相同,C原子核外电子数=18-1=17,故C为Cl元素;D元素是构成有机物的主要元素,其最外层电子数是最内层电子数的2倍,则D为C元素,据此解答.
解答 解:短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A离子为带两个单位正电荷的阳离子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由AO+2HCl═ACl2+H2O,M(AO)=$\frac{0.4g}{0.01mol/L}$=40g/mol,所以A的摩尔质量为40g/mol-16g/mol=24g/mol,又A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B是地壳中含量最多的金属元素,则B为Al.C得到一个电子后与氩的电子层结构相同,C原子核外电子数=18-1=17,故C为Cl元素;D元素是构成有机物的主要元素,其最外层电子数是最内层电子数的2倍,则D为C元素.
(1)由分析可知,B为铝,C为氯,故答案为:铝;氯;
(2)D为碳元素,处于元素周期表中第二周期ⅣA族,故答案为:第二周期ⅣA族;
(3)A为Mg元素,原子结构示意图为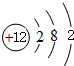 ,故答案为:
,故答案为: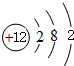 ;
;
(4)Mg在二氧化碳中燃烧生成MgO与C,其化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(5)氯气与石灰乳反应生成氯化钙、次氯酸钙与水,该反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(6)10mL浓度为1mol/L AlCl3水溶液中n(AlCl3)=0.01L×1mol/l=0.01mol,35mL浓度为1mol/L的苛性钠溶液中n(NaOH)=0.035L×1mol/l=0.035mol,将NaOH溶液滴入氯化铝溶液中,首先发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成氢氧化铝沉淀0.01mol,消耗NaOH0.03mol,剩余NaOH为0.035mol-0.03mol=0.005mol,然后发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,0.005molNaOH完全反应消耗0.005mol氢氧化铝,沉淀没有完全溶液,故整个过程现象为:先生成白色沉淀,后白色沉淀部分溶解,
故答案为:先生成白色沉淀,后白色沉淀部分溶解.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握元素化合物知识,(5)中注意根据计算判断现象,为易错点,学生容易忽略定量问题.

| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1 ) | 436 | 157 | 568 | 432 | 298 |
| A. | 432 kJ•mol -1>E(H-Br)>298 kJ•mol -1 | |
| B. | 表中最稳定的共价键是H-F键 | |
| C. | H 2 (g)→2H (g)△H=+436 kJ•mol -1 | |
| D. | H 2 (g)+F 2 (g)=2HF(g)△H=-25 kJ•mol -1 |
| A. | Ca2CO3+2HCl═CaCl2+H2O+CO2↑ | B. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ | ||
| C. | Cu+4HNO3(稀)═Cu(NO3)2+2NO↑+2H2O | D. | NaCl+AgNO3═AgCl↓+NaNO3 |
| A. | H2SO4 | B. | CuSO4 | C. | NaCl | D. | KOH |

| A. | 分子式是C20H12O4 | B. | 能与NaOH稀溶液反应,溶液显红色 | ||
| C. | 能与溴水反应,溶液显红色 | D. | 与羧酸发生酯化反应 |
| A. | 某温度时pH=6的纯水中含有10-6NA个H+ | |
| B. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 在25℃、1.01×105Pa时,121gCF2Cl2所含的氯原子数为2NA | |
| D. | 常温下,5.6g铁投入到足量的浓硝酸中,反应转移的电子数为0.3NA |
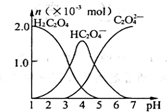 常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是
常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )
| A. | HC2O4-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=10 mL,时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=15 mL,时,溶液中存在:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=20 mL,时,溶液中存在:c(OH-)=c(HC2O4-)+2c(H2C2O4)+c(H+) |