题目内容
3.(1)在H2S的饱和溶液中存在着电离平衡,以电离方程式表示为H2S=HS-+H+; HS-=H++S2-.其中,c(HS-)>c(S2-),c (HS-)<c(H+),c(H+)>c(S2-).(填“>.<.=”)(2)若向该饱和溶液中加入固体烧碱,则c(S2-)增大,S2-物质的量增大,c(H+)减小.(填“增大,减小或不变”)
(3)若向原饱和溶液中加入无水硫酸铜粉末,经搅拌后,c(S2-)减小,电离平衡向正方向移动,c(H+)增大.(填“增大,减小或不变”)
分析 (1)H2S是二元弱酸,属弱电解质,分两步电离,第一步电离出氢离子和硫氢根离子,第二步电离为硫氢根离子电离出硫离子和氢离子,以第一步电离为主;
(2)当向H2S溶液中加入NaOH固体时,OH-与H+反应,硫化氢的电离平衡正移,c(S2-)增大,c(H+)减小;
(3)若向原饱和溶液中加入无水硫酸铜粉末,生成CuS沉淀,平衡向右移动,据此分析解答.
解答 解:(1)H2S是二元弱酸,属弱电解质,分两步电离,第一步电离出氢离子和硫氢根离子,第二步电离为硫氢根离子电离出硫离子和氢离子,电离方程式为:H2S?H++HS-,HS-?H++S2-;以第一步电离为主,所以c(HS-)>c(S2-),两步电离均有氢离子生成,所以c (HS-)<c(H+),c(H+)>c(S2-);
故答案为:H2S?H++HS-,HS-?H++S2-;>;<;>;
(2)H2S溶液中存在着H2S=H++HS-、HS-=H++S2-的平衡,当向H2S溶液中加入NaOH固体时,OH-与H+反应,减少生成物的浓度,平衡向正方向移动,所以c(H+)减小,c(S2-)增大,
故答案为:增大;增大;减小;
(3)H2S溶液中存在着H2S=H++HS-、HS-=H++S2-的平衡,若向原饱和溶液中加入无水硫酸铜粉末,生成CuS沉淀,c(S2-)减小,平衡向正方向移动,c(H+)增大;
故答案为:减小;正方向;增大.
点评 本题考查了弱电解质的电离,明确影响弱电解质电离的因素是解本题关键,题目难度不大,注意多元弱酸分步电离以第一步电离为主.

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
14.常温下,1mol化学键分解成气态原子所需要的能量用E表示.结合表中信息判断下列说法不正确的是( )
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1 ) | 436 | 157 | 568 | 432 | 298 |
| A. | 432 kJ•mol -1>E(H-Br)>298 kJ•mol -1 | |
| B. | 表中最稳定的共价键是H-F键 | |
| C. | H 2 (g)→2H (g)△H=+436 kJ•mol -1 | |
| D. | H 2 (g)+F 2 (g)=2HF(g)△H=-25 kJ•mol -1 |
11.下列说法正确的是( )
| A. | 需要加热发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温下一定能发生 | |
| C. | 温度压强一定时,放热的、熵增加反应能自发进行 | |
| D. | 吸热反应一定是反应物总能量大于生成物的总能量 |
18.在甲酸溶液中加入一定量的NaOH溶液,恰好完全反应,对于生成的溶液,下列判断一定正确的是( )
| A. | c(HCOO-)<c(Na+) | B. | c(HCOO-)>c(Na+) | C. | c(OH-)>c(HCOO-) | D. | c(OH-)<c(HCOO-) |
15.下列反应中属于氧化还原反应的是( )
| A. | Ca2CO3+2HCl═CaCl2+H2O+CO2↑ | B. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ | ||
| C. | Cu+4HNO3(稀)═Cu(NO3)2+2NO↑+2H2O | D. | NaCl+AgNO3═AgCl↓+NaNO3 |
12.用惰性电极电解下列溶液时在阴极有固体析出,在阳极有气泡产生的是( )
| A. | H2SO4 | B. | CuSO4 | C. | NaCl | D. | KOH |
13.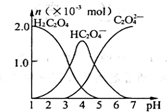 常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是
常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是
( )
 常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是
常温下,向10mL 0.2mol•L-1草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )
| A. | HC2O4-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=10 mL,时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=15 mL,时,溶液中存在:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=20 mL,时,溶液中存在:c(OH-)=c(HC2O4-)+2c(H2C2O4)+c(H+) |
 .
.
 .
. .
. .
.