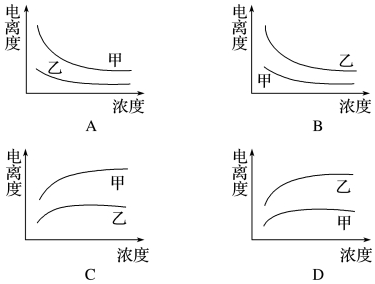
题目内容
13. 向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.(l)CO2的电子式是
 ;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.
;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.a.氯化钡溶液 b.次氯酸钙溶液 c.饱和苏打溶液 d.澄清石灰水 e.水玻璃
(2)碳酸锰热分解可制备重要化工原料二氧化锰并产生大量CO2,反应原理为2MnCO3+O2═2MnO2+2CO2.某温度下该平衡体系的压强为p,CO2、O2的物质的量分别为n1和n2,请用平衡分压代替平衡浓度,计算碳酸锰热分解反应的平衡常数k=$\frac{P{n}_{1}^{2}}{n2(n1+n2)}$(分压=总压×物质的量分数).
(3)C02和H2反应合成二甲醚,已知:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.1kJ•mol
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol
CO2(g)+H2(g)?C0(g)+H2O(g)△H3=+41.2kJ•mol
①由以上信息可知CO2(g)与H2(g)可转化为CH3OCH3(g)和H2O(g),当有6.9gCH3OCH3(g)生成时反应放出的热量为18.4kJ,转移的电子数为1.8NA.
②一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某个条件,下变化能说明平衡一定向正反应方向移动的是b.(填代号)
a.逆反应速率先增大后减小
b.H2的转化率增大
c.CO2的体积百分含量减小
d.容器中$\frac{c({H}_{2})}{c(C{O}_{2})}$的值减小
(4)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:
①b电极反应式为4OH--4e-═2H2O+O2↑,产生CO2原因是H++HCO3-═H2O+CO2↑.
②利用平衡移动原理,简述CO32-在阴极区再生的原因HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生,
故答案为:HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生..
分析 (l)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;先判断反应是否发生,再根据生成物的溶解性进行判断,难溶性的物质会产生沉淀,白色沉淀有:硅酸、碳酸氢钠晶体、难溶的碳酸盐等,以此解答;
(2)生成物浓度的幂之积比上反应浓度的幂之积,固体不代入表达式;2MnCO3+O2═2MnO2+2CO2的K=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$;
(3)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-49.1kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol-1
①根据盖斯定律①×2+②书写CO2(g)加H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式为:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-122.7 kJ•mol-1,为此可计算6.9gCH3OCH3(g)生成时反应放出的热量;依据关系:CH3OCH3~12e-计算转移的电子数;
②a.逆反应速率先增大后减小,说明平衡向逆反应方向移动;
b.H2的转化率增大,说明平衡向正反应方向移动;
c.CO2的体积百分含量减小,可能为减小二氧化碳的量使平衡向逆反应方向移动;
d.容器中c(H2)/c(CO2)的值减小,可能为减小氢气的量使平衡向逆反应方向移动;
(4)①阳极上氢氧根离子放电生成氧气;
②碳酸氢根离子程度电离平衡、氢氧根离子和碳酸氢根离子反应生成碳酸根离子;
解答 解:(l)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为  ;
;
a.向BaCl2溶液中通入少量的CO2不会发生反应,无沉淀出现,故a错误;
b.向Ca(ClO)2溶液通入过量CO2会生成次氯酸和碳酸氢钙,没有沉淀,故b错误;
c.苏打溶液为碳酸钠溶液,饱和碳酸钠溶液和二氧化碳反应生成碳酸氢钠,由于碳酸氢钠溶解度比碳酸钠小,则生成沉淀,故C正确;
d.向澄清石灰水溶液通入过量CO2会生成碳酸氢钙,没有沉淀,故d错误;
e.水玻璃是硅酸钠溶液,向Na2SiO3溶液中通入过量CO2会生成硅酸沉淀,故e正确;
故选ce;
故答案为: ;ce;
;ce;
(2)反应①的平衡常数表达式K1=$\frac{{c}^{2}(C{O}_{2})}{c({O}_{2})}$=$\frac{(\frac{Pn1}{n1+n2})^{2}}{\frac{Pn2}{n1+n2}}$=$\frac{P{n}_{1}^{2}}{n2(n1+n2)}$,
故答案为:$\frac{P{n}_{1}^{2}}{n2(n1+n2)}$;
(3)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-49.1kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol-1
①根据盖斯定律①×2+②,则CO2(g)加H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式为2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-122.7 kJ•mol-1,6.9gCH3OCH3(g)生成时反应放出的热量为:6.9g×$\frac{122.7KkJ/mol}{46g/mol}$=18.4kJ;
根据CH3OCH3~12e-(设可转移电子xmol
46 12
6.9 x
x=$\frac{6.9g×12mol}{46g}$=1.8mol
故答案为:18.4;1.8NA
②a.逆反应速率先增大后减小,说明平衡向逆反应方向移动,故不选;
b.H2的转化率增大,说明平衡向正反应方向移动,故选;
c.CO2的体积百分含量减小,可能为减小二氧化碳的量使平衡向逆反应方向移动,故不选;
d.容器中c(H2)/c(CO2)的值减小,可能为减小氢气的量使平衡向逆反应方向移动,故不选;
故选:b;
(4)①阳极上氢氧根离子放电生成氧气和水,电极反应式为4OH--4e-═2H2O+O2↑,
故答案为:4OH--4e-═2H2O+O2↑;
②HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生,
故答案为:HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小,平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生.
点评 本题考查化学平衡常数的含义,平衡移动、反应方向进行判断等相关知识,题目难度中等,试题综合性强,学生要有一定的化学基本功才能解决,试题培养了学生的灵活应用能力.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案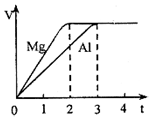
| A. | 物质的量之比为3:2 | B. | 质量之比为3:4 | ||
| C. | 摩尔质量之比为9:8 | D. | 体积之比为2:3 |
| A. | 单质碘 | B. | 硫化氢 | C. | 氯化镁 | D. | 氢氧化钠 |
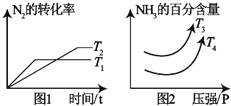 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:步骤一:氮气与氢气合成氨气;步骤二:氨气的催化氧化;步骤三:NO的氧化再水化.
请回答下列问题:
(1)对于N2(g)+3H2(g)═2NH3(g)△H1kJ/mol,满足如图1象:
①根据图△H1<0,T3<T4.(填“>”“<”“=”)
②若温度为T1且容积为2L的密闭容器下中,发生合成氨的反应,起始时通入2mol的N2和6mol的H2,10分钟达到平衡状态,此时NH3的体积分数为60%.则0到10min内用H2表示化学反应速率为0.225mol/(L•min),N2的转化率为75%,反应开始和平衡状态体系的压强之比等于8:5.T1温度下平衡常数K≈21.3,若升高温度K值减小.(填“增大”“减小”“不变”)
③若第②小问中反应体系达到平衡后,再通入1mol N2和3mol H2,则H2转化率增大.(填“增大”“减小”“不变”)
④若恒定温度为T1,容积为2L,则若开始通入2mol N2和2mol H2和2mol的NH3则反应开始时V正>V逆(填“>”“<”“=”),达到新的平衡状态后,再通入2mol N2,则N2的转化率降低.(填“升高”、“降低”或者“不变”)
⑤对于合成氨的体系中,既可以增大反应速率又可以提高H2的转化率的措施有增大压强和增大N2浓度.(填两点即可)
(2)已知:
| 化学键 | N≡N | H-H | N-H |
| 键能/kJ/mol | a | b | c |
(3)已知:
①N2(g)+3H2(g)═2NH3(g)△H1kJ/mol
②4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H2kJ/mol
③4NO(g)+3O2(g)+2H2O(g)═4HNO3(aq)△H3kJ/mol
则N2(g)+3H2(g)+4O2(g)═2HNO3(aq)+2H2O(l)△H=(△H1+0.5△H2+0.5△H3)kJ/mol(用a、b、c、△H2和△H3表示)