题目内容
18.下列物质中有非极性共价键的是( )| A. | 单质碘 | B. | 硫化氢 | C. | 氯化镁 | D. | 氢氧化钠 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,同种非金属形成非极性共价键,以此来解答.
解答 解:A.只含I-I非极性共价键,故A选;
B.只含H-S极性共价键,故B不选;
C.只含镁离子与氯离子之间的离子键,故C不选;
D.含离子键和O-H极性键,故D不选;
故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
11.维生素是参与生物生长发育和新陈代谢所必须的物质,中学生每天需要补充一定量的维生素C.下列食品中维生素C含量最丰富的是( )
| A. | 植物油 | B. | 馒头 | C. | 牛肉 | D. | 橙子 |
9.甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如表:
由此计算△H1=-99kJ•mol-1,已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1
(2)反应①的化学平衡常数K的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母).

(3)合成气的组成$\frac{n({H}_{2})}{n(CO+C{O}_{2})}$=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.a(CO)值随温度升高而减小(填“增大”或“减小”),图2中的压强由大到小为P3>P2>P1.
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如表:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)反应①的化学平衡常数K的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母).

(3)合成气的组成$\frac{n({H}_{2})}{n(CO+C{O}_{2})}$=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.a(CO)值随温度升高而减小(填“增大”或“减小”),图2中的压强由大到小为P3>P2>P1.
6.常温下,四种金属的氢氧化物的PKsp (PKsp=-lgKsp ),以及金属离子(起始浓度均为0.10mol/L)开始沉淀和沉淀完全(金属离子浓度≤10-6)时的pH等相关数据如下表:
下列说法正确的是( )
| 化学式 | pKsp | pH | |
| 开始沉淀时 | 沉淀完全时 | ||
| Mg(OH)2 | / | 10.8 | 13.3 |
| Cu(OH)2 | / | 4.4 | / |
| Fe(OH)3 | / | 1.5 | / |
| Al(OH)3 | 33 | / | / |
| A. | Mg(OH)2不溶于pH=7的CH3COONH4溶液 | B. | PKsp[Mg(OH)2]>PKsp[Cu(OH)2] | ||
| C. | Fe(OH)3的PKsp=38.5 | D. | Al3+在溶液中沉淀完全的pH=5 |
3.某化学反应2A (g)?B(g)+D(g) 在4种不同条件下进行,B和D的起始浓度为0,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如下表:
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是40min,实验4达到平衡的时间是30min.
(2)C1大于C2 (填“大于”“小于”“等于”);C3=1.0mol•L-1
(3)实验4比实验1的反应速率快(填“快”或“慢”),原因是实验4的温度比实验1高,温度越高,反应越快
(4)如果2A (g)?B(g)+D(g) 是一个放热反应,那么实验4与实验1相比,实验1 放出的热量多,理由是升高温度平衡向逆方向移动.
实验 序号 | 时间 浓度 温 度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | c1 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | c2 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1达到平衡的时间是40min,实验4达到平衡的时间是30min.
(2)C1大于C2 (填“大于”“小于”“等于”);C3=1.0mol•L-1
(3)实验4比实验1的反应速率快(填“快”或“慢”),原因是实验4的温度比实验1高,温度越高,反应越快
(4)如果2A (g)?B(g)+D(g) 是一个放热反应,那么实验4与实验1相比,实验1 放出的热量多,理由是升高温度平衡向逆方向移动.
 向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向. ;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.
;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.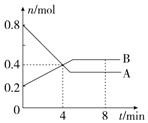 Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得: ;
;