题目内容
1.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)(1)在一定温度下,将1mol N2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol.
①达平衡时,H2的转化率α1=60%.
②已知平衡时,容器压强为8MPa,则平衡常数Kp=0.26(保留小数点后两位数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(2)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为NO2+NO3--e-=N2O5.

分析 (1)①设参加反应的氮气物质的量为xmol,
该反应中N2(g)+3H2(g)?2NH3(g)
起始(mol)1 3 0
变化(mol) x 3x 2x
平衡(mol) 1-x 3-3x 2x
列式可得:(1-x)+(3-3x)+2x=2.8,
x=0.6
则氮气转化率=$\frac{0.6mol}{1mol}$×100%=60%,
当加入的反应物的物质的量之比等于其计量数之比时,反应物的转化率相等;
②平衡时各物质的压强之比等于其物质的量之比,所以P(N2)=$\frac{(1-0.6)mol}{2.8mol}$×8MPa=$\frac{8}{7}$MPa,
P(H2)=$\frac{3×(1-0.6)mol}{2.8mol}$×8MPa=$\frac{24}{7}$MPa,P(NH3)=$\frac{(2×0.6)mol}{2.8mol}$×8MPa=$\frac{24}{7}$MPa,
化学平衡常数Kp=$\frac{{P}^{2}(N{H}_{3})}{P({N}_{2}).{P}^{3}({H}_{2})}$;
(2)该原电池中通入二氧化氮的电极是负极、通入氧气的电极是正极,所以I是负极、II是正极,负极上生成氧化物,应该是二氧化氮失电子和硝酸根离子反应生成五氧化二氮.
解答 解:(1)①设参加反应的氮气物质的量为xmol,
该反应中N2(g)+3H2(g)?2NH3(g)
起始(mol)1 3 0
变化(mol) x 3x 2x
平衡(mol) 1-x 3-3x 2x
列式可得:(1-x)+(3-3x)+2x=2.8,
x=0.6
则氮气转化率=$\frac{0.6mol}{1mol}$×100%=60%,
当加入的反应物的物质的量之比等于其计量数之比时,反应物的转化率相等,所以氢气转化率也是60%,
故答案为:60%;
②平衡时各物质的压强之比等于其物质的量之比,所以P(N2)=$\frac{(1-0.6)mol}{2.8mol}$×8MPa=$\frac{8}{7}$MPa,
P(H2)=$\frac{3×(1-0.6)mol}{2.8mol}$×8MPa=$\frac{24}{7}$MPa,P(NH3)=$\frac{(2×0.6)mol}{2.8mol}$×8MPa=$\frac{24}{7}$MPa,
化学平衡常数Kp=$\frac{{P}^{2}(N{H}_{3})}{P({N}_{2}).{P}^{3}({H}_{2})}$=$\frac{(\frac{24}{7})^{2}}{\frac{8}{7}×(\frac{24}{7})^{3}}$=0.26,故答案为:0.26;
(2)该原电池中通入二氧化氮的电极是负极、通入氧气的电极是正极,所以I是负极、II是正极,负极上生成氧化物,应该是二氧化氮失电子和硝酸根离子反应生成五氧化二氮,电极反应式为NO2+NO3--e-=N2O5,
故答案为:NO2+NO3--e-=N2O5.
点评 本题考查化学平衡计算、原电池原理,侧重考查学生分析判断及计算能力,注意三段式在化学平衡计算中的灵活应用,难点是电极反应式的书写,注意:如果反应物的物质的量之比等于其计量数之比时反应物的转化率相等,题目难点中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 5 | B. | 7 | C. | 8 | D. | 9 |
| A. | 盐酸 | B. | NH3 | C. | 熔融的Al2O3 | D. | BaSO4晶体 |
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如表:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)反应①的化学平衡常数K的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母).

(3)合成气的组成$\frac{n({H}_{2})}{n(CO+C{O}_{2})}$=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.a(CO)值随温度升高而减小(填“增大”或“减小”),图2中的压强由大到小为P3>P2>P1.
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.20 | |
| 4 | 0.80 |
②在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(2)在恒温恒容条件下关于反应CO(g)+Cl2?COCl2(g),下列说法中正确的是CD(填序号).
A.增大压强能使该反应速率加快,是因为增加了活化分子的百分数.
B.使用合适的催化剂可以增大反应体系中COCl2的体积分数
C.若改变某个反应条件,反应体系中COCl2的含量不一定增大
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡.
(3)用CO和H2在高温下合成C5H12(汽油的一种成分).已知5CO(g)+11H2(g)?C5H12(g)+5H2O(g)△H<0,若X、L分别代表温度或压强,图(1)表示L一定时,CO的转化率随X的变化关系,则C代表的物理量是温度,判断理由是该反应正反应为放热反应,由图中信息知,升高温度,平衡逆向移动,CO的转化率减小,所以X代表的物理量为温度.
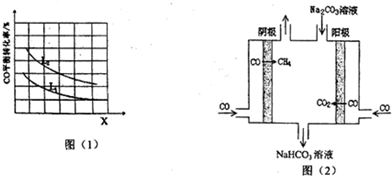
(4)工业上用CO通过电解法制备CH4,电解池的工作原理如图(2)所示,其阳极的电极反应式为CO+CO3 2-+H2O-2e-=2HCO3-;若每生成1mol CH4,理论上需要消耗CO的物质的量为4mol.
| 化学式 | pKsp | pH | |
| 开始沉淀时 | 沉淀完全时 | ||
| Mg(OH)2 | / | 10.8 | 13.3 |
| Cu(OH)2 | / | 4.4 | / |
| Fe(OH)3 | / | 1.5 | / |
| Al(OH)3 | 33 | / | / |
| A. | Mg(OH)2不溶于pH=7的CH3COONH4溶液 | B. | PKsp[Mg(OH)2]>PKsp[Cu(OH)2] | ||
| C. | Fe(OH)3的PKsp=38.5 | D. | Al3+在溶液中沉淀完全的pH=5 |
 向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向. ;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.
;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.