题目内容
8.在25℃下,向浓度均为0.1mol•L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.当体系中两种沉淀共存时,$\frac{C(M{g}^{2+})}{C(C{u}^{2+})}$=8.2×108(计算结果保留两位有效数字).已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.
分析 难溶电解质的溶度积越小,加入氨水时越易生成沉淀;铜离子与一水合氨反应生成氢氧化铜沉淀和铵根离子,据此书写离子方程式;
当两种沉淀共存时,$\frac{c(M{g}^{2}{\;}^{+})}{c(C{u}^{2}{\;}^{+})}$=$\frac{KsP[Cu(OH){\;}_{2}]}{Ksp[Mg(OH){\;}_{2}]}$,据此解答.
解答 解:难溶电解质的溶度积越小,溶解度越小,越易生成沉淀,依据25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20,可知氢氧化铜溶解度小于氢氧化镁,向浓度均为0.1mol•L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
当两种沉淀共存时,$\frac{c(M{g}^{2}{\;}^{+})}{c(C{u}^{2}{\;}^{+})}$=$\frac{KsP[Cu(OH){\;}_{2}]}{Ksp[Mg(OH){\;}_{2}]}$=$\frac{2.2×10{\;}^{-20}}{1.8×10{\;}^{-11}}$=8.2×108;
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+; 8.2×108;
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的计算及应用为解答的关键,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.H++OH-=H2O表示下列哪组离子反应( )
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Ba(OH)2与HCl | D. | KHSO4与Ba(OH)2 |
2.下列有机物命名正确的是( )
| A. | 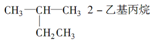 | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. | 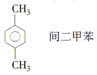 | D. |  |
16.研究发现,火力发电厂释放出的尾气是造成雾霾的主要原因之一,CO是其主要成分之一,为减少对环境造成的影响,发电厂试图采用以下方法将CO进行合理利用,以获得重要工业产品.
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
①反应0~2min末的平均速率v(COCl2)=0.1mol/(L?min).
②在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(2)在恒温恒容条件下关于反应CO(g)+Cl2?COCl2(g),下列说法中正确的是CD(填序号).
A.增大压强能使该反应速率加快,是因为增加了活化分子的百分数.
B.使用合适的催化剂可以增大反应体系中COCl2的体积分数
C.若改变某个反应条件,反应体系中COCl2的含量不一定增大
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡.
(3)用CO和H2在高温下合成C5H12(汽油的一种成分).已知5CO(g)+11H2(g)?C5H12(g)+5H2O(g)△H<0,若X、L分别代表温度或压强,图(1)表示L一定时,CO的转化率随X的变化关系,则C代表的物理量是温度,判断理由是该反应正反应为放热反应,由图中信息知,升高温度,平衡逆向移动,CO的转化率减小,所以X代表的物理量为温度.
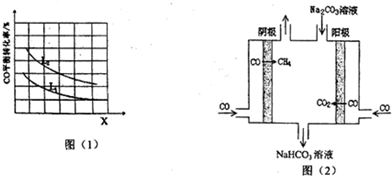
(4)工业上用CO通过电解法制备CH4,电解池的工作原理如图(2)所示,其阳极的电极反应式为CO+CO3 2-+H2O-2e-=2HCO3-;若每生成1mol CH4,理论上需要消耗CO的物质的量为4mol.
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.20 | |
| 4 | 0.80 |
②在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(2)在恒温恒容条件下关于反应CO(g)+Cl2?COCl2(g),下列说法中正确的是CD(填序号).
A.增大压强能使该反应速率加快,是因为增加了活化分子的百分数.
B.使用合适的催化剂可以增大反应体系中COCl2的体积分数
C.若改变某个反应条件,反应体系中COCl2的含量不一定增大
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡.
(3)用CO和H2在高温下合成C5H12(汽油的一种成分).已知5CO(g)+11H2(g)?C5H12(g)+5H2O(g)△H<0,若X、L分别代表温度或压强,图(1)表示L一定时,CO的转化率随X的变化关系,则C代表的物理量是温度,判断理由是该反应正反应为放热反应,由图中信息知,升高温度,平衡逆向移动,CO的转化率减小,所以X代表的物理量为温度.

(4)工业上用CO通过电解法制备CH4,电解池的工作原理如图(2)所示,其阳极的电极反应式为CO+CO3 2-+H2O-2e-=2HCO3-;若每生成1mol CH4,理论上需要消耗CO的物质的量为4mol.
17.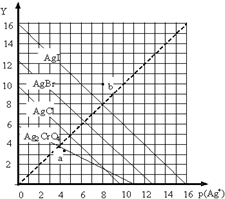 一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
 一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )| A. | a点表示c(Ag+)=c(CrO42-) | |
| B. | b点可表示AgI的饱和溶液 | |
| C. | 该温度下AgI的Ksp约为1×10-16 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
18.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO为8mol.下列说法正确的是( )
| A. | 保持其他条件不变,升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7 mol | |
| D. | CO的平衡转化率为80% |
 向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向. ;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.
;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce. 如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图.请指出A、B、C、D分别与①②③④相匹配的可能组合:A与③; B与②④(或①②④);C与①; D与④.
如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图.请指出A、B、C、D分别与①②③④相匹配的可能组合:A与③; B与②④(或①②④);C与①; D与④.