题目内容
4.镁是一种重要的金属资源,在工业上用途广泛.回答下列问题:(1)已知某温度下Mg(OH)2的Ksp=6.4×l0-12,当溶液中c(Mg2+)≤1.0×10-5mol/L可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥8×10-4mol•L-1.
(2)已知常温下CH3COOH的电离常数为:Ka=l.75×10-5mol/L;NH3•H2O的电离常数为Kb=1.76×l0-5mol/L.
A.NH4Cl溶液显酸性,原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示),NH4Cl溶液中所有离子的浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
B. CH3COONH4溶液显中 (填“酸”、“碱”或“中”)性.
C.将饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,可看到白色沉淀溶解.产生这种现象的原因存在以下两种观点.
观点①:2NH4++Mg(OH)2═2NH3•H2O+Mg2+;
观点②的离子方程式为NH4++H2O?NH3•H2O+H+、Mg(OH)2+2H+=Mg2++2H2O.
要验证①和②谁是Mg(OH)2溶解的主要原因,可选取c(填序号)代替NH4Cl溶液作对照实验.
a. NH4NO3 b. (NH4)2SO4 c. CH3COONH4 d. NH4HSO4.
分析 (1)结合c(OH-)=$\sqrt{\frac{Ksp}{c(M{g}^{2+})}}$计算;
(2)A.氯化铵中铵根离子水解显碱性;
B.醋酸与一水合氨的电离平衡常数相等;
C.将饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,可看到白色沉淀溶解.产生这种现象的原因存在以下两种观点.
观点①:2NH4++Mg(OH)2═2NH3•H2O+Mg2+;
观点②为铵根离子水解生成的氢离子与氢氧化镁反应,可利用醋酸铵代替NH4Cl溶液作对照实验说明.
解答 解:(1)当溶液中c(Mg2+)≤1.0×10-5mol/L可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥$\sqrt{\frac{6.4×10-12}{1×1{0}^{-5}}}$=8×10-4mol•L-1,故答案为:8×10-4;
(2)A..氯化铵中铵根离子水解显碱性,发生水解离子反应为NH4++H2O?NH3•H2O+H+,离子浓度为 c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:NH4++H2O?NH3•H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
B.醋酸与一水合氨的电离平衡常数相等,则CH3COONH4溶液显中性,故答案为:中;
C.观点②的离子方程式为NH4++H2O?NH3•H2O+H+、Mg(OH)2+2H+=Mg2++2H2O;利用醋酸铵代替NH4Cl溶液作对照实验说明,若仍溶液可知观点①成立,反应②成立,
故答案为:NH4++H2O?NH3•H2O+H+、Mg(OH)2+2H+=Mg2++2H2O;c.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的计算、盐类水解、平衡移动为解答的关键,侧重分析与应用能力的考查,注意溶解平衡移动的实验探究,题目难度不大.

| A. | MnO2 | B. | Fe3O4 | C. | MgO | D. | Cr2O3 |
| A. | 0.025 mol/L | B. | 0.30mol/L | C. | 0.36mol/L | D. | 0.45mol/L |
| A. | 盐酸 | B. | NH3 | C. | 熔融的Al2O3 | D. | BaSO4晶体 |
| A. | 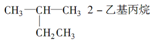 | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. | 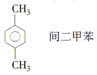 | D. |  |
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如表:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)反应①的化学平衡常数K的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母).

(3)合成气的组成$\frac{n({H}_{2})}{n(CO+C{O}_{2})}$=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.a(CO)值随温度升高而减小(填“增大”或“减小”),图2中的压强由大到小为P3>P2>P1.
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.20 | |
| 4 | 0.80 |
②在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(2)在恒温恒容条件下关于反应CO(g)+Cl2?COCl2(g),下列说法中正确的是CD(填序号).
A.增大压强能使该反应速率加快,是因为增加了活化分子的百分数.
B.使用合适的催化剂可以增大反应体系中COCl2的体积分数
C.若改变某个反应条件,反应体系中COCl2的含量不一定增大
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡.
(3)用CO和H2在高温下合成C5H12(汽油的一种成分).已知5CO(g)+11H2(g)?C5H12(g)+5H2O(g)△H<0,若X、L分别代表温度或压强,图(1)表示L一定时,CO的转化率随X的变化关系,则C代表的物理量是温度,判断理由是该反应正反应为放热反应,由图中信息知,升高温度,平衡逆向移动,CO的转化率减小,所以X代表的物理量为温度.
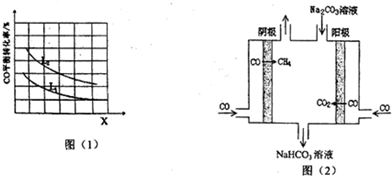
(4)工业上用CO通过电解法制备CH4,电解池的工作原理如图(2)所示,其阳极的电极反应式为CO+CO3 2-+H2O-2e-=2HCO3-;若每生成1mol CH4,理论上需要消耗CO的物质的量为4mol.
| A. | 锥形瓶可用作加热的反应器 | |
| B. | 室温下,不能将浓硫酸盛放在铁桶中 | |
| C. | 在50mL量筒中配置0.1000mol•L-1碳酸钠溶液 | |
| D. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 |
 向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向. ;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.
;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.