题目内容
2.化学反应原理在科研和生产中有广泛应用(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.
C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ•mol-1,△S=+133.7J•mol-1•K-1,
该反应在低温下不能(填“能”或“不能”)自发进行.
(2)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应TaS2(s)+2I2(g)?TaI4(g)+S2(g)△H>0 ( I)反应( I)的平衡常数表达式K=$\frac{c(Ta{I}_{4})c({S}_{2})}{{c}^{2}({I}_{2})}$,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为66.7%
(3)已知在400℃时,N2(g)+3H2(g)?2NH3(g)的K=0.5.
①在400℃时,2NH3(g)?N2(g)+3H2(g)的K′=2(填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正=(填“>”“<”“=”或“不确定”)v(N2)逆.
(4)离子液体是一种室温熔融盐,为非水体系.由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.钢制品接电源的负极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为4Al2Cl7-+3e-═Al+7AlCl4-.为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6mol电子时,所得还原产物的物质的量为3mol.
分析 (1)反应自发进行的判断依据是△H-T△S<0;
(2)化学平衡常数等于各生成物平衡浓度系数次幂之积和各反应物平衡浓度系数次幂之积的比值;结合化学平衡常数劣势计算,转化率=$\frac{消耗量}{起始量}$×100%计算;
(3)①相同温度下,同一可逆反应的正逆平衡常数互为倒数关系;
②根据浓度熵和平衡常数之间的关系来判断反应的状态;
(4)电镀原理分析,钢铁上镀铝是利用铝做阳极,钢铁做阴极,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体做电解液来实现;改用AlCl3水溶液作电解液是溶液中氢离子在阴极放电生成氢气;依据铝和氢氧化钠反应的化学方程式分析判断,还原产物为氢气.
解答 解:(1)C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ•mol-1,△S=+133.7J•mol-1•K-1,)△H-T△S=131.3kJ/mol-T×0.1337KJ/(mol•K),低温时,131.3kJ/mol-T×0.1337KJ/(mol•K)>0,反应不能自发进行,
故答案为:不能;
(2)反应(Ⅰ)TaS2(s)+2I2(g)?TaI4(g)+S2(g)△H>0 的平衡常数表达式K=$\frac{c(Ta{I}_{4})c({S}_{2})}{{c}^{2}({I}_{2})}$,若K=1,设 I2的平衡转化率为x,则参加反应的为xmol,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,K=$\frac{c(Ta{I}_{4})c({S}_{2})}{{c}^{2}({I}_{2})}$=$\frac{0.5x×0.5x}{(1-x)^{2}}$=1,解之得:x=66.7%,
故答案为:$\frac{c(Ta{I}_{4})c({S}_{2})}{{c}^{2}({I}_{2})}$;66.7%
(3)①相同温度下,同一可逆反应的正逆平衡常数互为倒数关系,在400℃时,N2(g)+3H2(g)?2NH3(g)的K′=0.5,则2NH3(g)?N2(g)+3H2(g)的K=$\frac{1}{{K}^{'}}$=2;
故答案为:2;
②一段时间后,当N2、H2、NH3的物质的量分别为4mol/L、2mol/L、4mol/L时,Qc=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$=0.5,QC=K所以该状态是平衡状态,正逆反应速率相等;
故答案为:=;
(4)电镀原理分析,钢铁上镀铝是利用铝做阳极与电源正极相连,钢铁做阴极与电源负极相连,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体做电解液来实现,离子液体是一种室温熔融盐,为非水体系,电镀过程中不产生其他离子且有机阳离子不参与电极反应,则阴极反应生成铝是发生的还原反应,铝元素化合价降低,分析离子液体成分,结合电荷守恒分析可知是Al2Cl7-得到电子生成,电极反应为:4Al2Cl7-+3e-=Al+7AlCl4-;改用AlCl3水溶液作电解液是溶液中氢离子在阴极放电生成氢气,2H++2e-=H2↑;依据铝和氢氧化钠反应的化学方程式分析,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,还原产物为氢气,当反应转移6mol电子时,所得还原产物的物质的量为3mol,
故答案为:负;4Al2Cl7-+3e-=Al+7AlCl4-;H2 ;3.
点评 本题考查学生化学平衡常数的计算、电解原理等知识点、反应进行的方向知识,注意三行式计算的方法和电解原理的分析是关键,题目难度中等.

 作业辅导系列答案
作业辅导系列答案| A. | 盐酸 | B. | NH3 | C. | 熔融的Al2O3 | D. | BaSO4晶体 |
 一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )| A. | a点表示c(Ag+)=c(CrO42-) | |
| B. | b点可表示AgI的饱和溶液 | |
| C. | 该温度下AgI的Ksp约为1×10-16 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
| A. | 锥形瓶可用作加热的反应器 | |
| B. | 室温下,不能将浓硫酸盛放在铁桶中 | |
| C. | 在50mL量筒中配置0.1000mol•L-1碳酸钠溶液 | |
| D. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 |
 向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向. ;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.
;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.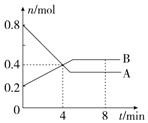 Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得: