题目内容
16.卤族元素是典型的非金属元素,其单质及其化合物具有广泛的用途.已知:KMnO4与浓盐酸常温下反应可生成氯气.根据所学化学知识及所给信息,回答下列有关问题:(1)下列可以用来判断氯、溴、碘元素非金属性强弱的是②④⑤(填序号).
①Cl2、Br2、I2的颜色逐渐加深;
②Cl2、Br2、I2的氧化性逐渐减弱;
③HCl、HBr、HI的酸性依次减弱;
④HCl、HBr、HI的热稳定性逐渐减弱;
⑤Cl2、Br2、I2和H2反应条件由光照(或点燃)→一定温度→持续加热;条件由易到难;
⑥AgCl、AgBr、AgI的颜色逐渐加深.
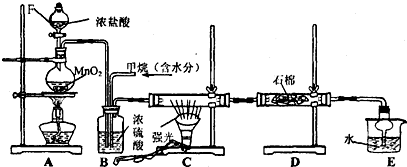
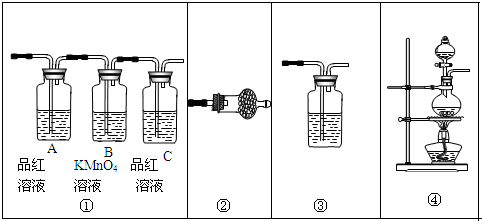
(2)某化学探究小组选用图1所示的装置和下列所给的试剂来证明非金属性:Cl>I,请你按照他们的设计思路完成该实验.
可供选择的试剂有:①稀盐酸,②浓硫酸,③MnO2,④浓盐酸,⑤淀粉碘化钾溶液,⑥KMnO4,⑦NaOH溶液;⑧硝酸银溶液
烧瓶A中应盛放的药品是⑥(填序号),试管C中应盛放的药品是⑤(填序号),则装置D的作用是吸收未反应完的氯气,防止污染环境.观察到C中溶液变蓝现象,即可证明非金属性Cl>I.
(3)一定条件,在水溶液中1mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如图2所示.
①D是ClO4-(填离子符号).
②B→A+C反应的离子方程式为3ClO-=ClO3-+2Cl-;生成1molC时,放出117KJ的热(填吸收或放出以及具体数值)

分析 (1)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱,据此分析;
(2)KMnO4与浓盐酸反应生成氯气,氯气具有强氧化性,能将碘离子氧化为碘单质,碘遇淀粉试液变蓝色,由此分析解答;
(3)①根据图2可知,D中Cl元素化合价为+7价,根据ClOX-中化合价代数和为-1判断x值;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,据此答题.
解答 解:(1)①Cl2、Br2、I2的颜色逐渐加深,是物理性质,无法比较非金属性强弱,故①错误;
②Cl2、Br2、I2的氧化性逐渐减弱,说明非金属性减弱,能够据此判断氯、溴、碘元素非金属性强弱,故②正确;
③HCl、HBr、HI的酸性不是最高价含氧酸,无法据此判断非金属性强弱,故③错误; ④HCl、HBr、HI的热稳定性逐渐减弱,说明非金属性减弱,能够据此判断氯、溴、碘元素非金属性强弱,故④正确;
⑤Cl2、Br2、I2和H2反应条件由光照(或点燃)→一定温度→持续加热,条件由易到难,说明非金属性减弱,能够据此判断氯、溴、碘元素非金属性强弱,故⑤正确;
⑥AgCl、AgBr、AgI的颜色逐渐加深,与非金属性强弱无关,无法据此判断氯、溴、碘元素非金属性强弱,故⑥错误;
故答案为:②④⑤;
(2)KMnO4与浓盐酸反应生成氯气,氯气与淀粉碘化钾混合溶液反应生成碘单质,碘遇淀粉试液变蓝色,故C中溶液变为蓝色,氯气与淀粉碘化钾混合溶液反应离子方程式为:Cl2+2I-═2Cl-+I2,则证明了非金属性:Cl>I,所以烧瓶A中应盛放的药品是KMnO4;试管C中应盛放的药品是粉碘化钾溶液,则装置D的作用是用氢氧化钠吸收多余的氯气,防止污染环境;当观察到现象溶液变为蓝色可证明非金属性Cl>I,
故答案为:⑥;⑤;吸收未反应完的氯气,防止污染环境;C中溶液变蓝;
(3)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-,
故答案为:ClO4-;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以生成1molClO3-时,放出117kJ的热,
故答案为:3ClO-=ClO3-+2Cl-;放出117.
点评 本题考查实验方案设计,涉及非金属性强弱的比较,反应热的有关计算等知识,题目难度中等,明确物质的性质是解本题关键,试题有利于提高学生的分析能力及化学实验能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | BaSO4的水溶液导电性极弱:BaSO4?Ba2++SO42- | |
| B. | KHSO4在熔融状态下可导电:KHSO4=K++H++SO42+ | |
| C. | 常温下,0.1 mol/L的HF 溶液的pH>1:HF+H2O?H3O++F- | |
| D. | 向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH- |
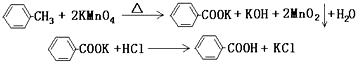
 阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$\stackrel{85℃-90℃加热}{→}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品
主要试剂和产品的物理常数如表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:
粗产品$→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{减压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酰杨酸
①沸石的作用是防止暴沸;
②冷凝水的流出方向是c(填“b”或“c”);
③使用温度计的目的是便于调控加热温度,防止乙酰水杨酸受热分解.
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
(1)本实验至少需要加热2次.至少需要称量4次.
(2)通过实验知道,要确保结果的准确性,本实验中的一个关键是通过恒重操作来判断硫酸铜晶体加热时是否完全变成无水硫酸铜.
(3)学生甲实验得到以下的数据:
| 坩埚质量(g) | 坩埚和晶体的总质量(g) | 加热后坩埚和剩余固体的质量(g) |
| 11.685 | 13.691 | 12.948 |
(4)若学生乙的实验结果偏低,从下列选项中选出造成结果偏低的可能原因de(填序号).
a.加热前称量时坩埚未完全干燥 b.加热过程中有少量晶体溅出
c.加热时坩埚内物质变黑 d.加热后放在空气中冷却
e.最后两次加热后称量的质量差大于0.001g.