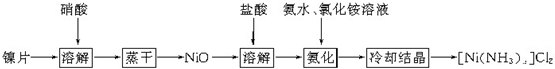
题目内容
6.根据测定硫酸铜晶体中结晶水含量的实验,填写下列空白:(1)本实验至少需要加热2次.至少需要称量4次.
(2)通过实验知道,要确保结果的准确性,本实验中的一个关键是通过恒重操作来判断硫酸铜晶体加热时是否完全变成无水硫酸铜.
(3)学生甲实验得到以下的数据:
| 坩埚质量(g) | 坩埚和晶体的总质量(g) | 加热后坩埚和剩余固体的质量(g) |
| 11.685 | 13.691 | 12.948 |
(4)若学生乙的实验结果偏低,从下列选项中选出造成结果偏低的可能原因de(填序号).
a.加热前称量时坩埚未完全干燥 b.加热过程中有少量晶体溅出
c.加热时坩埚内物质变黑 d.加热后放在空气中冷却
e.最后两次加热后称量的质量差大于0.001g.
分析 (1)测定流程为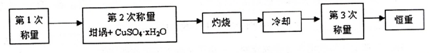 ,需要加热2次再测定质量,实验前测定坩埚的质量、坩埚和晶体的质量;
,需要加热2次再测定质量,实验前测定坩埚的质量、坩埚和晶体的质量;
(2)利用加热后两次测定的质量不变判断硫酸铜晶体加热时完全变成无水硫酸铜;
(3)由表格的数据可知,晶体的质量为13.691g-11.685g=2.006g,结晶水的质量为13.691g-12.948g=0.743g,结合CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O计算;
(4)造成结果偏低,则不当操作导致水的质量测定偏小,以此来解答.
解答 解:(1)由 ,需要加热2次再测定质量,实验前测定坩埚的质量、坩埚和晶体的质量可知,本实验至少需要加热2次.至少需要称量4次,故答案为:2;4;
,需要加热2次再测定质量,实验前测定坩埚的质量、坩埚和晶体的质量可知,本实验至少需要加热2次.至少需要称量4次,故答案为:2;4;
(2)通过实验知道,要确保结果的准确性,本实验中的一个关键是通过恒重操作来判断硫酸铜晶体加热时是否完全变成无水硫酸铜,
故答案为:恒重操作;
(3)由表格的数据可知,晶体的质量为13.691g-11.685g=2.006g,结晶水的质量为13.691g-12.948g=0.743g,
CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O
160+18x 18x
2.006g 0.743g
$\frac{160+18x}{2.006g}$=$\frac{18x}{0.743g}$,
解得x=5.23,
故答案为:5.23;
(4)a.加热前称量时坩埚未完全干燥,水的质量偏大,造成结果偏高,故不选;
b.加热过程中有少量晶体溅出,水的质量偏大,造成结果偏高,故不选
c.加热时坩埚内物质变黑,硫酸铜分解生成CuO,水的质量偏大,造成结果偏高,故不选;
d.加热后放在空气中冷却,水的质量偏小,造成结果偏低,故选;
e.最后两次加热后称量的质量差大于0.001g,结晶水没有完全失去,水的质量偏小,造成结果偏低,故选;
故答案为:de.
点评 本题考查物质含量的测定实验,为高频考点,把握测定原理、实验仪器的使用、实验技能等为解答的关键,侧重分析与实验能力的考查,注意结晶水含量的误差分析,题目难度中等.

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案| A. | 主族元素的电负性越大,元素原子的第一电离能一定越大 | |
| B. | 在元素周期表中,元素电负性从左到右越来越小 | |
| C. | 在形成化合物时,电负性越小的元素越容易显正价 | |
| D. | 金属元素的电负性一定小于非金属元素的电负性 |
| A. | 同族元素,随着核外电子层数的增加,I1逐渐增大 | |
| B. | 通常情况下,对于同一种元素的原子,其电离能I1<I2<I3 | |
| C. | 同周期元素,总体变化趋势是随着核电荷数的增加,I1增大 | |
| D. | 通常情况下,电离能越小,元素的金属性越强 |
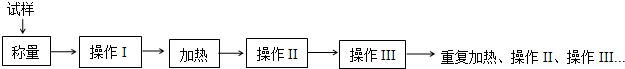
回答下列问题:
(1)实验已有仪器:电子天平、酒精灯、铁三脚架,从下列仪器中选出实验还需要的仪器A、B、E、F、G(用标号字母填写)
A.干燥器 B.研钵 C.试管夹 D.蒸发皿 E.坩埚 F.玻璃棒 G.药匙
除上述列出的仪器外,还需要的仪器是泥三角、坩埚钳.
(2)某学生在实验中得到数据如表.据此计算 x=5.9(精确到0.1)
| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 5.400g | 7.900g | 6.900g | 6.901g |
a.加热前称量时容器未完全干燥
b.最后两次加热后的质量相差较大
c.加热后容器未放入干燥器中冷却
d.加热过程中有少量溅失.
 实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CH
实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CHCH2=CH2+Br2→BrCH2CH2Br
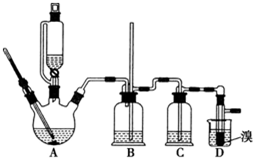
可能存在的主要副反应有:乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚. 用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如图所示:
有关数据列表如下
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到 170℃左右,其最主要目 的是d;(填正确选项前的字母)
a.引发反应b.加快反应速度c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置 C 中应加入c,其目的是吸收反应中可能生成的酸 性气体:(填正确选项前的字母)
a.水b.浓硫酸 c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层 (填“上”、“下”);
(5)若产物中有少量未反应的 Br2,最好用b洗涤除去;(填正确选 项前的字母)
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置 D,其主要目的是冷却可避免溴的大量挥发; 但又不能过度冷却 (如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| A. | 称量样品→加热→冷却→称量CuO | |
| B. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 | |
| C. | 称量样品→加热→冷却→称量Cu(NO3)2 | |
| D. | 称量样品→加NaOH→过滤→加热→冷却→称量CuO |