题目内容
9.用化学用语解释相关现象正确的是( )| A. | BaSO4的水溶液导电性极弱:BaSO4?Ba2++SO42- | |
| B. | KHSO4在熔融状态下可导电:KHSO4=K++H++SO42+ | |
| C. | 常温下,0.1 mol/L的HF 溶液的pH>1:HF+H2O?H3O++F- | |
| D. | 向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH- |
分析 A.BaSO4在溶液中溶解度很小,完全电离;
B.KHSO4在熔融状态下电离出钾离子和硫酸氢根离子;
C.HF是弱电解质,在溶液中部分电离;
D.酸性条件下,不能生成氢氧根离子.
解答 解:A.BaSO4在溶液中溶解度很小,溶液中带电离子的浓度很小,导电性极弱,但是BaSO4是强电解质完全电离,不存在电离平衡,故A错误;
B.KHSO4在熔融状态下电离出钾离子和硫酸氢根离子,其电离方程式为:KHSO4=K++HSO4-,故B错误;
C.HF是弱电解质,在溶液中部分电离,0.1 mol/L的HF 溶液的氢离子的浓度小于0.1mol/L,所以pH>1:即HF+H2O?H3O++F-;故C正确;
D.向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+4H+=2I2+2H2O,故D错误.
故选C.
点评 本题考查了电解质的电离、离子反应方程式的书写,把握发生的反应及离子反应的书写方法为解答的关键,注意氧化还原反应及离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
20.下列溶液中Cl-的物质的量浓度与l00mL,1mol/L MgCl2溶液中Cl-的物质的量浓度相同的是( )
| A. | 50 mL 2 mol/L CaCl2溶液 | B. | 100 mL 2 mol/L NaCl溶液 | ||
| C. | 50 mL 4 mol/L CaCl2溶液 | D. | 100 mL 2 mol/L KClO3溶液 |
17.已知热化学方程式2SO2(g)+O2(g)?2SO3(g);△H=-QkJ/mol(Q>0),则下列说法正确的是( )
| A. | 2molSO2(g)和1mol O2(g)所具有的键能总和大于2 molSO3(g)所具有的键能总和 | |
| B. | 将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QKJ的热量 | |
| C. | 升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小 | |
| D. | 如将一定量SO2(g)和O2(g)于某密闭容器中充分反应后放热QKJ,则此过程中有2molSO2(g)被氧化 |
4.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: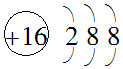 | |
| B. | NH4Cl的电子式: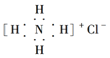 | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | HBr的形成过程: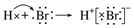 |
14.已知C-C可以绕键轴旋转,对于结构简式如图所示的烃,下列说法正确的是( )


| A. | 分子中最多有12个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃的一氯取代物最多有4种 | |
| D. | 该烃是苯的同系物 |
1.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色反应呈黄色.五种元素核电荷数之和为54,W、Z最外层电子数相同,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质.则下列说法不正确的是( )
| A. | 原子半径:X>Y>Z>Q>W | |
| B. | 最高价氧化物对应的水化物的酸性:Z<Q | |
| C. | Q和W可形成原子个数比为1:1和1:2的化合物 | |
| D. | X、Y和W三种元素形成的化合物的水溶液呈碱性 |

 ①盐泥a除泥沙外,还含有的物质是Mg(OH)2.
①盐泥a除泥沙外,还含有的物质是Mg(OH)2.