题目内容
1. 阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$\stackrel{85℃-90℃加热}{→}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品
主要试剂和产品的物理常数如表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:
粗产品$→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{减压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酰杨酸
①沸石的作用是防止暴沸;
②冷凝水的流出方向是c(填“b”或“c”);
③使用温度计的目的是便于调控加热温度,防止乙酰水杨酸受热分解.
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
分析 醋酸酐和水杨酸混合,然后向混合溶液中加入浓硫酸,摇匀后加热至85℃,然后冷却、过滤、水洗得到粗产品,然后向粗产品中加入饱和碳酸氢钠溶液,使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,从而除去杂质;然后加入浓盐酸除去剩余的碳酸氢钠、将乙酰水杨酸钠转化为乙酰水杨酸,最后过滤、洗涤、干燥得到乙酰水杨酸,
(1)乙酸酐容易发生水解,故仪器应干燥;
(2)控制温度在85℃~90℃,温度低于100℃,应采取水浴加热;
(3)①沸石可以防止液体在受热时瀑沸;
②冷凝水流向为“下进上出”,这样冷却效果好;
③由于加热时温度不能过高,应控制在一定范围之内,故使用温度计;
(4)计算理论生成乙酰水杨酸的质量,可计算出产率.
解答 解:(1)乙酸酐容易发生水解生成乙酸,故仪器应干燥防止乙酸酐水解,
故答案为:防止乙酸酐水解;
(2)控制温度在85℃~90℃,小于100℃,应使用水浴加热,
故答案为:水浴加热;
(3)①沸石可以防止液体在受热时瀑沸,
故答案为:防止暴沸;
②冷凝水流向为“下进上出”,这样冷却效果好,所以冷凝水的流出方向是c,故选c;
③由于加热时温度不能过高,应控制在一定范围之内,故使用温度计便于调控加热温度,防止乙酰水杨酸受热分解,
故答案为:便于调控加热温度,防止乙酰水杨酸受热分解;
(4)n(水杨酸)=$\frac{2.0g}{138g/mol}$=0.0145mol,n(醋酸酐)=$\frac{5.0mL×1.08g/mL}{102g/mol}$=0.053mol,则理论上生成乙酰水杨酸0.0145mol,产率为$\frac{2.2g}{0.0145mol×180g/mol}$=84.3%,
故答案为:84.3%.
点评 本题考查有机物合成的方案设计与评价,题目难度中等,本题注意把握实验操作原理,把握题给信息,掌握实验操作方法,学习中注意积累.


| A. | 分子中最多有12个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃的一氯取代物最多有4种 | |
| D. | 该烃是苯的同系物 |

该反应后的混合物含有:3,5-二甲氧基苯酚、甲醇、水和HCl.
已知:甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质如下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/(g/cm3) | 溶解性 |
| 甲醇 | 64.7 | - | 0.795 | 易溶于水 |
| 乙醚 | 34.5 | - | 0.7138 | 难溶于水 |
| 3,5-二甲氧基苯酚 | 172 | 36 | - | 易溶于甲醇、乙醚、微溶于水 |
(1)利用与其它物质 差异较大的特点,可先用蒸馏法分离出甲醇,蒸馏操作时使用的玻璃仪器有:酒精灯、蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶.
(2)①蒸馏出甲醇后,加入乙醚进行萃取、分液操作,有机层在分液漏斗的上层.
②双项选择:选用乙醚这种试剂的主要原因是BC.
A.乙醚易挥发
B.3,5-二甲氧基苯酚在乙醚中溶解度大于在水中的溶解度
C.乙醚难溶于水
D.3,5-二甲氧基苯酚熔点较低
(3)经上述步骤分离得到的有机层再用饱和NaHCO3溶液洗涤,其目的是除去HCl.
(4)洗涤完成后,加入无水CaCl2干燥,过滤除去干燥剂,蒸馏除去乙醚,得到固体产物,为进一步提纯固体产物还要进行重结晶操作.
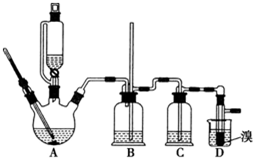 实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CH
实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CHCH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚. 用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如图所示:
有关数据列表如下
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到 170℃左右,其最主要目 的是d;(填正确选项前的字母)
a.引发反应b.加快反应速度c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置 C 中应加入c,其目的是吸收反应中可能生成的酸 性气体:(填正确选项前的字母)
a.水b.浓硫酸 c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层 (填“上”、“下”);
(5)若产物中有少量未反应的 Br2,最好用b洗涤除去;(填正确选 项前的字母)
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置 D,其主要目的是冷却可避免溴的大量挥发; 但又不能过度冷却 (如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
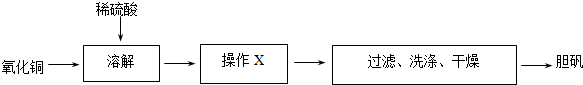

 某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.