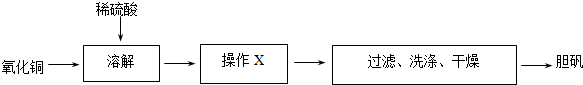
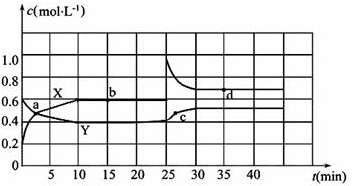
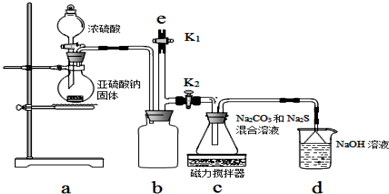
题目内容
4.利用甲烷与氯气发生反应制取盐酸的设想,在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下: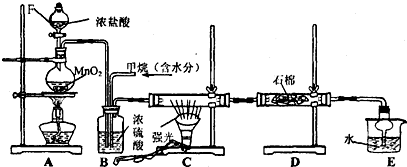
根据要求填空:
(1)装置A中反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)B装置有三种功能:
①控制气流速度;②使气体混合均匀;③干燥气体.
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式CH4+2Cl2$\stackrel{hv}{→}$C+4HCl.
(4)D装置中的石棉上均匀附着湿润的KI粉末,其作用是吸收未反应的氯气,E装置的作用是吸收HCl,防止倒吸.
(5)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为分液;
该装置还有缺陷,原因是没有进行尾气处理,写出尾气中的主要成分是AB.
(填编号)
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
(6)实验之余,该学习小组进一步探究甲烷与氯气反应的条件.
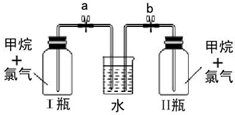
通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1:4)混合气体(Ⅰ、Ⅱ),Ⅱ瓶用预先准备好的黑色纸套套上,I瓶放在光亮处(不要放在日光直射的地方,以免引起爆炸).按上图安装好装置,并夹紧弹簧夹a和b.过一段时间,打开弹簧夹a、b,Ⅰ、Ⅱ中观察到现象是在I瓶中:颜色逐渐变浅,且有油状液体产生,出现白雾,并可以看见水倒吸入I瓶中.
分析 A装置是用浓盐酸和二氧化锰加热制取氯气,B装置中氯气和甲烷充分混合,C装置在光照条件下氯气和甲烷发生取代反应生成氯代烃和HCl,D装置中的石棉上均匀附着湿润的KI粉末,氯气具有强氧化性,能氧化碘离子生成碘单质,HCl极易溶于水,可以用水吸收生成的HCl;
(1)在加热条件下,二氧化锰和浓盐酸反应生成氯化锰、氯气和水;
(2)B装置中含有浓硫酸,浓硫酸具有吸水性;该装置中氯气和甲烷充分混合;
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,说明有C生成,根据反应物、生成物及反应条件书写方程式;
(4)氯气具有强氧化性,能氧化还原性物质,E装置中水能吸收可溶性物质,且导致的干燥管能防止倒吸;
(5)互不相溶的液体可以采用分液方法分离提纯;
甲烷和一氯甲烷都是气体且不溶于水;
(6)氯气和甲烷发生取代反应生成氯代烃和HCl,HCl极易溶于水,氯气为黄绿色气体,氯代烃和甲烷都是无色物质,二氯甲烷、三氯甲烷、四氯化碳都是油状液体,HCl遇水蒸气生成盐酸小液滴.
解答 解:A装置是用浓盐酸和二氧化锰加热制取氯气,B装置中氯气和甲烷充分混合,C装置在光照条件下氯气和甲烷发生取代反应生成氯代烃和HCl,D装置中的石棉上均匀附着湿润的KI粉末,氯气具有强氧化性,能氧化碘离子生成碘单质,HCl极易溶于水,可以用水吸收生成的HCl;
(1)在加热条件下,二氧化锰和浓盐酸反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)B装置中含有浓硫酸,浓硫酸具有吸水性;该装置中氯气和甲烷充分混合,所以该装置的作用还有使气体混合均匀、干燥气体,
故答案为:使气体混合均匀;干燥气体;
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,说明有C生成,根据反应物、生成物及反应条件书写方程式为CH4+2Cl2$\stackrel{hv}{→}$ C+4HCl,故答案为:CH4+2Cl2$\stackrel{hv}{→}$ C+4HCl;
(4)氯气具有强氧化性,能氧化还原性物质KI,所以氯气的作用是吸收未反应的氯气,E装置中水能吸收可溶性物质,且导致的干燥管能防止倒吸,所以E装置作用是 吸收HCl,防止倒吸,
故答案为:吸收未反应的氯气; 吸收HCl,防止倒吸;
(5)互不相溶的液体可以采用分液方法分离提纯,二氯甲烷、三氯甲烷、四氯化碳都不溶于水,但HCl极易溶于水,可以采用分液方法分离提纯;
甲烷和一氯甲烷都是气体且不溶于水,所以还要处理尾气中的甲烷和一氯甲烷,
故答案为:分液;AB;
(6)氯气和甲烷发生取代反应生成氯代烃和HCl,HCl极易溶于水,氯气为黄绿色气体,氯代烃和甲烷都是无色物质,二氯甲烷、三氯甲烷、四氯化碳都是油状液体,HCl遇水蒸气生成盐酸小液滴,所以看到I中的现象是颜色逐渐变浅,且有油状液体产生,出现白雾,并可以看见水倒吸入I瓶中,
故答案为:在I瓶中:颜色逐渐变浅,且有油状液体产生,出现白雾,并可以看见水倒吸入I瓶中.
点评 本题考查物质制备,为高频考点,明确物质性质、化学反应原理水解本题关键,侧重考查学生实验操作、物质分离提纯、物质性质,难点是判断B装置的作用,“气体在该装置中混合均匀“很多学生回答不出来.

| A. | 2molSO2(g)和1mol O2(g)所具有的键能总和大于2 molSO3(g)所具有的键能总和 | |
| B. | 将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QKJ的热量 | |
| C. | 升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小 | |
| D. | 如将一定量SO2(g)和O2(g)于某密闭容器中充分反应后放热QKJ,则此过程中有2molSO2(g)被氧化 |
查阅相关资料,得到主要试剂及产物的性质:
| 物质 | 相对分子质量 | 性质 |
| 废饮料瓶碎片 | 聚对苯二甲酸乙二醇酯:乳白色或浅黄色的聚合物. | |
| 乙二醇(EG) | 62 | 无色无臭液体,对动物有毒性.沸点:196~198℃,与水混溶. |
对苯二甲酸(TPA) | 166 | 白色晶体或粉末,低毒.弱酸.300℃以上升华.不溶于水、乙醚、氯仿等大多数有机溶剂,可溶于DMF等强极性有机溶剂. |
(一)解聚
实验装置如图所示,A为三颈烧瓶,B为直形冷凝管,C为吸滤芯瓶,各接口均为玻璃接口.向装置中加入一定量废饮料瓶碎片及辅助试剂(催化剂、水等).缓慢搅拌,加热.待温度计上的温度显示高出200℃时,停止加热.则:
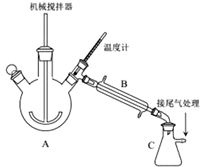
(1)写出聚对苯二甲酸乙二醇酯解聚的化学反应方程式:
 .
.(2)C中收集到的是乙二醇;C装置吸滤瓶不能(填“能”或“不能”)换页成敞口锥形瓶,原因:乙二醇有毒,不能直接排放到空气中.
(3)成品聚对苯二甲酸乙二酯是一种结晶性好,无色透明,极为坚韧的材料.有玻璃的外观,无臭、无味、无毒,易燃,燃烧时,产生蓝色边缘的黄色火焰.其燃烧反应属于D.
A.聚合反应 B.加成聚合反应
C.综合聚合反应 D.高分子化学反应
(4)工业上生产“PET”的反应式为:
 ,生产时,若消耗EG的物质的量比TPA多4‰,则上述聚合物的链节数n为250.
,生产时,若消耗EG的物质的量比TPA多4‰,则上述聚合物的链节数n为250. | A. | 同族元素,随着核外电子层数的增加,I1逐渐增大 | |
| B. | 通常情况下,对于同一种元素的原子,其电离能I1<I2<I3 | |
| C. | 同周期元素,总体变化趋势是随着核电荷数的增加,I1增大 | |
| D. | 通常情况下,电离能越小,元素的金属性越强 |

 ①盐泥a除泥沙外,还含有的物质是Mg(OH)2.
①盐泥a除泥沙外,还含有的物质是Mg(OH)2.