题目内容
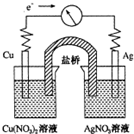 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是( )| A、KNO3盐桥中的K+移向Cu(NO3)2溶液 |
| B、Ag作负极,Cu作正极 |
| C、工作一段时间后,Cu(NO3)2溶液中c(Cu2+)增大 |
| D、取出盐桥后,电流计的指针依然发生偏转 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、铜为负极,银为正极,所以K+移向KNO3溶液移动;
B、活泼的铜为负极,银为正极;
C、负极铜放电生成铜离子;
D、取出盐桥后,不能构成闭合回路,不是原电池.
B、活泼的铜为负极,银为正极;
C、负极铜放电生成铜离子;
D、取出盐桥后,不能构成闭合回路,不是原电池.
解答:
解:A、铜为负极,银为正极,所以K+移向KNO3溶液移动,故A错误;
B、活泼的铜为负极,银为正极,故B错误;
C、负极铜放电生成铜离子到溶液中,所以Cu(NO3)2溶液中c(Cu2+)增大,故C正确;
D、取出盐桥后,不能构成闭合回路,不是原电池,所以指针不发生偏转,故D错误;
故选C.
B、活泼的铜为负极,银为正极,故B错误;
C、负极铜放电生成铜离子到溶液中,所以Cu(NO3)2溶液中c(Cu2+)增大,故C正确;
D、取出盐桥后,不能构成闭合回路,不是原电池,所以指针不发生偏转,故D错误;
故选C.
点评:本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题.

练习册系列答案
相关题目
下列反应能用CO32-+2H+═CO2↑+H2O表示的是( )
| A、Na2CO3+H2SO4═Na2SO4+CO2↑+H2O |
| B、CaCO3+2HCl═CaCl2+CO2↑+H2O |
| C、KHCO3+HCl═KCl+CO2↑+H2O |
| D、BaCO3+2HNO3═Ba(NO3 )2+CO2↑+H2O |
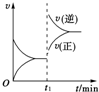 如图为某可逆反应的速率与时间的关系示意图,在t1时刻改变的条件为升温或增大压强,则该可逆反应可以是(提示:即升温或增大压强时均能符合如右图所示的速率与时间图象)( )
如图为某可逆反应的速率与时间的关系示意图,在t1时刻改变的条件为升温或增大压强,则该可逆反应可以是(提示:即升温或增大压强时均能符合如右图所示的速率与时间图象)( )| A、4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0 |
| B、2SO2(g)+O2(g)═2SO3(g)△H<0 |
| C、H2(g)+I2(g)═2HI(g)△H>0 |
| D、C(s)+H2O(g)═CO(g)+H2(g)△H>0 |
常温下,一定量的醋酸与氢氧化钠溶液发生中和反应,当溶液中( )
| A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 |
| B、c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全中和 |
| C、c(CH3COO-)=c(Na+)时,该溶液一定呈中性 |
| D、c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,可能是氢氧化钠过量 |
下列反应是制取某一种香料的中间过程: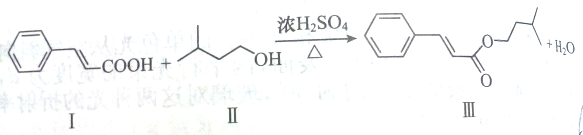
下列有关说法正确的是( )

下列有关说法正确的是( )
| A、Ⅱ物质的名称为2-甲基-4-丁醇 |
| B、Ⅲ物质的分子式为C14H18O2 |
| C、Ⅰ物质的9个碳原子一定共面 |
| D、Ⅲ物质中有3种官能团 |
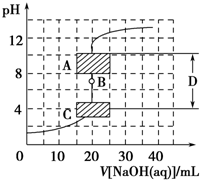 滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种.
滴定法是中学化学中一种十分重要的定量分析方法.滴定法又可进一步分为酸碱中和滴定、氧化还原滴定等若干种. H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).
H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸).