题目内容
下列反应能用CO32-+2H+═CO2↑+H2O表示的是( )
| A、Na2CO3+H2SO4═Na2SO4+CO2↑+H2O |
| B、CaCO3+2HCl═CaCl2+CO2↑+H2O |
| C、KHCO3+HCl═KCl+CO2↑+H2O |
| D、BaCO3+2HNO3═Ba(NO3 )2+CO2↑+H2O |
考点:化学方程式的书写
专题:
分析:能用离子方程式CO32-+2H+═H2O+C02↑表示的反应,必须满足可溶性的碳酸盐与强酸或多元强酸的酸式盐反应生成可溶性盐的一类反应,据此进行判断.
解答:
解:A.纯碱溶液中加入硫酸,碳酸钠为可溶性的盐,硫酸为强酸,二者反应生成可溶性的硫酸钠,其离子方程式可以用CO32-+2H+═H2O+C02↑表示,故A正确;
B.石灰石为碳酸钙,碳酸钙为难溶物,离子方程式中需要保留化学式,该反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;
C.KHCO3为多元弱酸的酸式盐,离子方程式中应该写成碳酸氢根离子形式,该反应的离子方程式为HCO3-+H+═H2O+C02↑,故C错误;
D.碳酸钡为难溶物,离子方程式中需要保留化学式,该反应的离子方程式为BaCO3+2H+═Ba2++CO2↑+H2O,故D错误;
故选A.
B.石灰石为碳酸钙,碳酸钙为难溶物,离子方程式中需要保留化学式,该反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;
C.KHCO3为多元弱酸的酸式盐,离子方程式中应该写成碳酸氢根离子形式,该反应的离子方程式为HCO3-+H+═H2O+C02↑,故C错误;
D.碳酸钡为难溶物,离子方程式中需要保留化学式,该反应的离子方程式为BaCO3+2H+═Ba2++CO2↑+H2O,故D错误;
故选A.
点评:本题考查了离子方程式的判断,题目难度不大,注意明确离子方程式的书写方法,熟悉常见的难溶物、弱电解质、气体,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
已知450℃,1.0×105Pa时,在有适当催化剂存在下:2SO2(g)+O2(g)═2SO3(g);△H=-Q kJ?mol-1,在相同温度和压强下,向一密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1 kJ,在相同温度和压强下,向另一密闭容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2 kJ,则下列关系中正确的是( )
| A、2Q2=Q1<Q |
| B、2Q2<Q1=Q |
| C、2Q2<Q1<Q |
| D、Q1=2Q2=Q |
下列有关主族元素形成的离子的叙述正确的是( )
| A、单核阳离子的电子层结构(除氢外)一定与上一周期稀有气体原子相同 |
| B、单核阳离子的电子层数一定比其他原子的电子层数少 |
| C、单核阴离子的半径一定比其原子半径大 |
| D、单核阴离子最外层一定是八电子结构 |
下列有关化学用语表达正确的是( )
| A、二氧化硅的分子式:SiO2 |
B、H2O2的电子式: |
C、乙酸分子的球棍模型: |
D、离子结构示意图  可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注.
U是一种重要的核燃料,这里的“235”是指该原子的( )
235 92 |
| A、质量数 | B、质子数 |
| C、中子数 | D、电子数 |
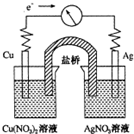 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是( )| A、KNO3盐桥中的K+移向Cu(NO3)2溶液 |
| B、Ag作负极,Cu作正极 |
| C、工作一段时间后,Cu(NO3)2溶液中c(Cu2+)增大 |
| D、取出盐桥后,电流计的指针依然发生偏转 |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
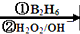 R-CH2CH2OH;
R-CH2CH2OH;