题目内容
常温下,一定量的醋酸与氢氧化钠溶液发生中和反应,当溶液中( )
| A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 |
| B、c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全中和 |
| C、c(CH3COO-)=c(Na+)时,该溶液一定呈中性 |
| D、c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,可能是氢氧化钠过量 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:醋酸为弱电解质,不能完全电离,与NaOH发生中和反应,当溶液中c(CH3COO-)=c(Na+)时,醋酸过量,结合盐类的水解和电荷守恒分析.
解答:
解:A.若醋酸和氢氧化钠恰好反应,由于生成物醋酸钠溶液中醋酸根离子水解,溶液显碱性,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),不一定氢氧化钠过量,故A错误;
B.根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知,当c(CH3COO-)=c(Na+)时,c(OH-)=c(H+),即溶液显中性,此时醋酸应该是过量的,故B错误;
C.根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知,当c(CH3COO-)=c(Na+)时,c(OH-)=c(H+),即溶液显中性,此时醋酸应该是过量的,故C正确;
D.醋酸恰好反应生成醋酸钠,溶液中醋酸根离子水解显碱性,若c(H+)>c(OH-)时说明溶液中醋酸过量,可能是等物质的量的醋酸和醋酸钠的混合溶液,若醋酸和氢氧化钠恰好反应,由于生成物醋酸钠溶液中醋酸根离子水解,溶液显碱性,c(Na+)>c(CH3COO-),氢氧化钠过量时,溶液呈碱性,则c(CH3COO-)<c(Na+),故D错误;
故选C.
B.根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知,当c(CH3COO-)=c(Na+)时,c(OH-)=c(H+),即溶液显中性,此时醋酸应该是过量的,故B错误;
C.根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知,当c(CH3COO-)=c(Na+)时,c(OH-)=c(H+),即溶液显中性,此时醋酸应该是过量的,故C正确;
D.醋酸恰好反应生成醋酸钠,溶液中醋酸根离子水解显碱性,若c(H+)>c(OH-)时说明溶液中醋酸过量,可能是等物质的量的醋酸和醋酸钠的混合溶液,若醋酸和氢氧化钠恰好反应,由于生成物醋酸钠溶液中醋酸根离子水解,溶液显碱性,c(Na+)>c(CH3COO-),氢氧化钠过量时,溶液呈碱性,则c(CH3COO-)<c(Na+),故D错误;
故选C.
点评:本题考查酸碱混合的定性判断以及离子浓度大小比较问题,题目难度中等,注意结合溶液电中性原则分析.

练习册系列答案
相关题目
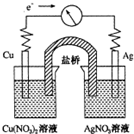 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是( )| A、KNO3盐桥中的K+移向Cu(NO3)2溶液 |
| B、Ag作负极,Cu作正极 |
| C、工作一段时间后,Cu(NO3)2溶液中c(Cu2+)增大 |
| D、取出盐桥后,电流计的指针依然发生偏转 |
下列金属中,其离子溶于水中不会造成水体污染的是( )
| A、铅 | B、铬 | C、钠 | D、汞 |

 按要求回答下列问题:
按要求回答下列问题: