题目内容
地球化学中,通常用热重分析研究矿物在受热时的质量变化一确定其组成.取66.6mg由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热,在673K~1123K区间内分解为氧化物,样品总失重13.8mg.
求方解石的失重百分比.
求方解石的失重百分比.
考点:化学方程式的有关计算,有关混合物反应的计算
专题:
分析:根据方程式,导致失重的原因是CaCO3=CaO+CO2,然后综合分析求解.
解答:
解:因为CaCO3的分子量为100,有方程式:
CaCO3=CaO+CO2,
CO2分子量为44,碳酸钙与二氧化碳物质的量之比为1:1,所以方解石的失重百分比为44%,答:求方解石的失重百分比为:44%.
CaCO3=CaO+CO2,
CO2分子量为44,碳酸钙与二氧化碳物质的量之比为1:1,所以方解石的失重百分比为44%,答:求方解石的失重百分比为:44%.
点评:本题考查根据方程式计算,学生只要正确分析导致失重的原因,然后根据反应原理去解答,比较容易.

练习册系列答案
相关题目
已知450℃,1.0×105Pa时,在有适当催化剂存在下:2SO2(g)+O2(g)═2SO3(g);△H=-Q kJ?mol-1,在相同温度和压强下,向一密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1 kJ,在相同温度和压强下,向另一密闭容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2 kJ,则下列关系中正确的是( )
| A、2Q2=Q1<Q |
| B、2Q2<Q1=Q |
| C、2Q2<Q1<Q |
| D、Q1=2Q2=Q |
2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注.
U是一种重要的核燃料,这里的“235”是指该原子的( )
235 92 |
| A、质量数 | B、质子数 |
| C、中子数 | D、电子数 |
有一在空气中暴露过的KOH固体,经分析知含水7.12%,K2CO32.88%,KOH 90%,若将此样品1g加入到46.00mL 1mol/L盐酸中,过量的酸再用1.07mol/LKOH溶液恰好中和,蒸发中和后的溶液可得固体( )g.
| A、6.07 | B、2.62 |
| C、4.54 | D、3.43 |
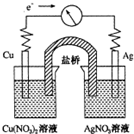 将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是( )
将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是( )| A、KNO3盐桥中的K+移向Cu(NO3)2溶液 |
| B、Ag作负极,Cu作正极 |
| C、工作一段时间后,Cu(NO3)2溶液中c(Cu2+)增大 |
| D、取出盐桥后,电流计的指针依然发生偏转 |
已知某氧化剂XO3-中+5价的X能被Na2SO3还原成0价,则还原含有2.4×10-3molXO3-的溶液,需0.2mol?L-1的Na2SO3溶液的体积为( )
| A、40mL | B、30mL |
| C、20mL | D、10mL |
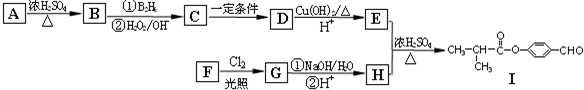
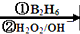 R-CH2CH2OH;
R-CH2CH2OH; A、B、C三种元素的粒子结构示意图如图所示
A、B、C三种元素的粒子结构示意图如图所示