题目内容
9.在除杂质的实验操作中,为了将溶液中的杂质完全去除,通常需加入过量的除杂质试剂.某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤: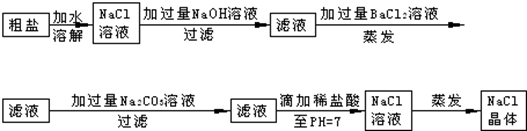
试简要说明:
(1)加入过量BaCl2的溶液的原因使硫酸根离子完全沉淀而除去.
(2)加入过量Na2CO3的溶液的原因使钡离子完全沉淀而除去.
(3)滴加稀盐酸直至pH=7的目的是除去过量的氢氧根和碳酸根,得到氯化钠溶液.
分析 在粗盐的提纯时,除镁离子用氢氧化钠,除硫酸根离子用氯化钡,除去过量的钡离子用碳酸钠,最后加入盐酸将氢氧化钠和碳酸钠除掉,蒸发结晶得到氯化钠晶体.
(1)在粗盐提纯时,加入氯化钡的目的是除去硫酸根离子;
(2)粗盐溶液中的钙离子可以加碳酸钠来去除;
(3)滴加稀盐酸可以除去过量的氢氧根和碳酸根,得到氯化钠溶液,根据反应的实质来回答.
解答 解:(1)在粗盐提纯时,加入过量的氯化钡的目的是除去硫酸根离子,并将之除尽,故答案为:使硫酸根离子完全沉淀而除去;
(2)粗盐溶液中的钙离子可以加碳酸钠来去除,所以碳酸钠的作用是:使钡离子完全沉淀而除去,故答案为:使钡离子完全沉淀而除去;
(3)在粗盐提纯时,最后一步加盐酸,滴加稀盐酸可以除去过量的氢氧根和碳酸根,发生的反应有:
HCl+NaOH=NaCl+H2O,2HCl+Na2CO3=2NaCl+H2O+CO2↑,最后得到氯化钠溶液,
故答案为:除去过量的氢氧根和碳酸根,得到氯化钠溶液.
点评 本题考查物质分离和提纯的方法和基本操作综合应用,难度中等,除去杂质的同时,要保证不能使所需物质的量减少,但可以增加,更不能引入新的杂质,所加试剂一般要求过量,以便将杂质除尽,并且,生成物、所选试剂与所需物质要容易分离.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
19.下列说法正确的是( )
| A. | 常温常压下,22gCO2气体中所含分子数大于0.5NA | |
| B. | 1LCO2和1LCO所含分子数相同 | |
| C. | 等质量的O2和O3,所含的原子数一定相等 | |
| D. | 1mol•L-1的NaOH溶液中Na+数目为NA |
4.要除去石英沙中的少量杂质碳酸钙,可采用的方法是( )
| A. | 用水溶解后过滤分离 | B. | 用稀盐酸溶解过滤分离 | ||
| C. | 用稀硫酸溶解过滤分离 | D. | 用酒精灯加热 |
14.化学与生产、生活密切联系.下列有关说法不正确的是( )
| A. | 网状结构的聚丙烯酸钠是高吸水性树脂,可用于制造“尿不湿” | |
| B. | 光导纤维应避免在强碱性环境中使用 | |
| C. | 利用超临界C02流体作为萃取溶剂符合绿色化学 | |
| D. | 船体镀锌或锡均可保护船体,镀层破损后将立即失去保护作用 |
1.X、Y、Z、W、J是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)元素Y位于元素周期表第三周期第VI族.
(3)元素Z的原子最外层共有17种不同运动状态的电子.
(4)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.W的基态原子核外价电子排布图是 .
.
(5)元素Y与元素Z相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(6)Y、Z两元素的最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4(用化学式表示).比较下列物质的酸性强弱:HZO<HZO3<HZO4.
(7)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的常见分子的分子式为CO.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
(2)元素Y位于元素周期表第三周期第VI族.
(3)元素Z的原子最外层共有17种不同运动状态的电子.
(4)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.W的基态原子核外价电子排布图是
 .
.(5)元素Y与元素Z相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(6)Y、Z两元素的最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4(用化学式表示).比较下列物质的酸性强弱:HZO<HZO3<HZO4.
(7)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的常见分子的分子式为CO.
18.将21.75g MnO2粉末与80mL 10mol•L-1的浓盐酸混合,在密闭容器中加热使其充分反应后,可得到标况下的Cl2的体积(V)是( )
| A. | V=4.48 L | B. | V=5.6 L | C. | 4.48 L<V<5.6 L | D. | V<4.48 L |
19.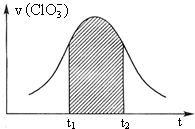 KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )
KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )
 KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )
KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )| A. | 开始时反应速率增大可能是由c(H+)增大所致 | |
| B. | 纵座标为v(H+)的v-t曲线与右图曲线完全重合 | |
| C. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| D. | 阴影部分面积可以表示t1-t2时间内c(Cl-)增加 |
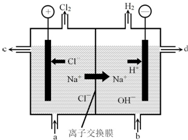 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.