题目内容
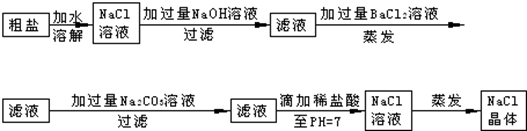
17.MnO2是重要无机材料,某小组设计了将粗MnO2(含有MnO、MnCO3和Fe2O3等杂质)样品转化为纯MnO2实验,流程如下:
(已知:氧化性强弱顺序:ClO3->MnO2>Fe3+)
(1)铝与二氧化锰在高温下发生置换反应,该反应的化学方程式为2Al+3MnO2$\frac{\underline{\;\;△\;\;}}{\;}$3Mn+2Al2O3.
(2)请配平第②步反应的离子方程式:
5Mn2++2ClO3-+4H2O=5 MnO2↓+1Cl2↑+8H+
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、酒精灯、蒸发皿;
第③步蒸发得到的固体中除了含有NaClO3和NaOH外,还一定含有NaCl(写化学式).
(4)若粗MnO2样品质量为23.0g,标准状况下,第①步反应收集448mLCO2气体,则原样品中MnCO3的质量百分含量为10.0%(MnCO3相对分子质量为115).
分析 粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品中加入过量的稀硫酸,由于MnO2不溶于硫酸,则样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,过滤得滤液为硫酸锰溶液,加入NaClO3发生反应为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,再过滤得到滤液和二氧化锰固体,而氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,以此解答该题.
解答 解:粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品中加入过量的稀硫酸,由于MnO2不溶于硫酸,则样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,过滤得滤液为硫酸锰溶液,加入NaClO3发生反应为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,再过滤得到滤液和二氧化锰固体,而氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,
(1)铝与二氧化锰在高温下发生置换反应,生成锰和氧化铝,方程式为2Al+3MnO2$\frac{\underline{\;\;△\;\;}}{\;}$3Mn+2Al2O3,
故答案为:2Al+3MnO2$\frac{\underline{\;\;△\;\;}}{\;}$3Mn+2Al2O3;
(2)MnSO4要转化为MnO2,需失去电子,故需要加入NaClO3做氧化剂,依据得失电子守恒可以配平,所以反应的化学方程式是:5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,因此反应的离子方程式是:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,
故答案为:5;2;4;5;1;8;
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、酒精灯、蒸发皿,第④步操作中NaOH过量,发生的反应为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,则最终得到的固体除NaClO3、NaOH外还含有NaCl,
故答案为:酒精灯、蒸发皿;NaCl;
(4)n(MnCO3)=(CO2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,则m(MnCO3)=0.02mol×115g/mol=2.3g,则原样品中MnCO3的质量百分含量为$\frac{2.3g}{23g}×100%$=10.0%,
故答案为:10.0%.
点评 本题考查物质的分离与提纯方法的综合应用,题目难度中等,把握流程中发生的化学反应及原电池和电解池原理为解答的关键,注意掌握化学实验基本操作方法,试题侧重分析能力及推断能力的考查.

| A. | 已知K=$\frac{{c}^{2}C{O}_{2}•{c}^{6}•{H}_{2}}{{c}^{3}{H}_{2}O•cC{H}_{3}C{H}_{2}OH}$,则对应的化学反应可以表示为2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g) | |
| B. | 将某浓度氢氟酸溶液升高温度,氢氟酸的电离度(α)和电离平衡常数Ka都变大 | |
| C. | 常温下,向纯水中加入碳酸钠,水的电离程度变大,KW变大 | |
| D. | 化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 |
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| A. | 单位物质的量的气体所占的体积就是气体摩尔体积 | |
| B. | 通常状况下的气体摩尔体积约为22.4 L | |
| C. | 标准状况下的气体摩尔体积约为22.4 L | |
| D. | 相同物质的量的气体摩尔体积也相同 |
| A. | H2O2 | B. | HClO | C. | Cl2 | D. | SO2 |
| A. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制 Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | 少量SO2通入NaClO溶液中:SO2+3ClO-+H2O═SO42-+Cl-+2HClO |
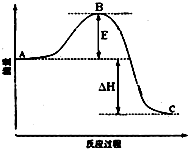 安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.
安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.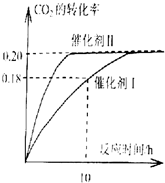 已知CO2可以生产绿色燃料甲醇,反应如下:
已知CO2可以生产绿色燃料甲醇,反应如下: