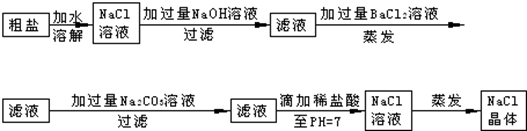
题目内容
1.X、Y、Z、W、J是元素周期表前四周期中的四种常见元素,其相关信息如下表:| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
(2)元素Y位于元素周期表第三周期第VI族.
(3)元素Z的原子最外层共有17种不同运动状态的电子.
(4)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.W的基态原子核外价电子排布图是
 .
.(5)元素Y与元素Z相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(6)Y、Z两元素的最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4(用化学式表示).比较下列物质的酸性强弱:HZO<HZO3<HZO4.
(7)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的常见分子的分子式为CO.
分析 X、Y、Z、W、J是元素周期表前四周期中的四种常见元素,X的基态原子核外3个能级上有电子,且每个能级上的电子数相同,X原子核外电子排布式为1s22s22p2,则X为碳元素;Y原子的M层上有2对成对电子,原子核外电子排布式为1s22s22p63s23p4,则Y为S元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl元素;W的一种核素的质量数为63,中子数为34,则其质子数=63-34=29,则W为Cu元素;J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐,则J为N元素,据此解答.
解答 解:X、Y、Z、W、J是元素周期表前四周期中的四种常见元素,X的基态原子核外3个能级上有电子,且每个能级上的电子数相同,X原子核外电子排布式为1s22s22p2,则X为碳元素;Y原子的M层上有2对成对电子,原子核外电子排布式为1s22s22p63s23p4,则Y为S元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl元素;W的一种核素的质量数为63,中子数为34,则其质子数=63-34=29,则W为Cu元素;J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐,则J为N元素.
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C,故答案为:146C;
(2)元素Y为S元素,位于元素周期表第三周期第VIA族,故答案为:三、VIA;
(3)元素Z为Cl,原子最外层共有17种不同运动状态的电子,故答案为:17;
(4)W为Cu,基态原子核外电子排布式是1s22s22p63s23p63d104s1,W的基态原子核外价电子排布图是 ,
,
故答案为:1s22s22p63s23p63d104s1; ;
;
(5)同周期自左而右非金属性增强,非金属性较强的是Cl,列表述中能证明这一事实的是.
a.常温下,Y的单质与Z的单质状态属于物理性质,不能比较非金属性强弱,故a错误;
b.等物质的量浓度的氢化物水溶液的酸性不能比较元素非金属性强弱,故b错误;
c.Z的电负性大于Y,说明Z的非金属性更强,故c正确;
d.元素非金属性越强,对应氢化物越稳定,故d正确;
e.非金属性强弱与获得电子难易程度有关,与获得电子数目多少无关,故e错误;
f.元素的非金属性越强,对应元素最高价氧化物对应水化物的酸性越强,故f正确,
故答案为:Cl;cdf;
(6)元素的非金属性越强,对应元素最高价氧化物对应水化物的酸性越强,故酸性HClO4>H2SO4,同种元素含氧酸中元素化合价越高,酸性越强,故酸性:HClO<HClO3<HClO4,
故答案为:HClO4>H2SO4;<、<;
(7)J的气态氢化物为NH3,N原子形成3个N-H键、含有一个孤对电子,杂化轨道数目为4,中心原子的杂化方式是sp3,该原子形成的单质分子为N2,与氮气分子互为等电子体的常见分子为CO,
故答案为:sp3;CO.
点评 本题考查结构性质位置关系应用,涉及核外电子排布、元素周期律、杂化方式判断与等电子体等,难度中等,推断元素是解题关键,注意掌握金属性、非金属性强弱比较实验事实.

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案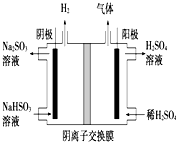 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:| 温 度 | 200℃300℃400℃ |
| 平衡常数 | K1 K2 K3 |
(2)下列描述中能说明上述反应已达到平衡的是bd(填序号)
a.v(O2)正=2v(SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)在上述平衡体系中加入18O2,当平衡发生移动后,SO2中18O的百分含量增加(填增加、减少、不变)其原因是该反应是可逆反应,在SO2和18O2反应生成S18O3的同时,S18O3又分解生成S18O2.
(4)一定温度下,把2molSO2和1molO2通入一恒容密闭容器中,平衡时SO3的体积分数为x.保持温度不变,若初始加入的SO2、O2和SO3的物质的量分别为a、b、c,当a、b、c的取值满足下列关系时才能保证达到平衡时SO3的体积分数仍为x.
①a+c=2(填a与c的关系)、②2b+c=2(填b、c的关系).
(5)工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式4OH--4e-=2H2O+O2,阳极区逸出气体的成分为O2、SO2(填化学式).
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.40}{t_1}$mol/(L•min) | |
| B. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至1000℃,上述反应平衡常数为1.6,则正反应为放热反应 |
| A. | H2O2 | B. | HClO | C. | Cl2 | D. | SO2 |
| A. | 1molO2在任何情况下都是32g | B. | 摩尔是一个基本物理量 | ||
| C. | H2SO4的摩尔质量是98g | D. | 1摩尔氢的质量是2g |
Ⅰ.查阅资料:铜的化合物颜色性质如下
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
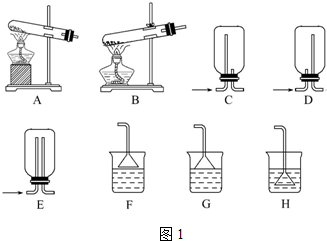
(2)实验验证 取电解CuCl2溶液后的阴极石墨电极,洗涤、干燥,连接下列装置进行实验,验证阴极产物
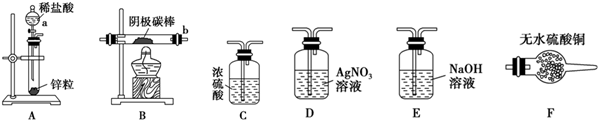
①实验前,检查装置A气密性的方法是将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗的活塞,水的液面不会连续下降,证明装置A的气密性好.
②实验时,各装置从左至右的连接顺序为A→E→C→B→F→D.(填装置代号)
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象
①碳棒上的红色物质是否有Cu2O否(填“是”或“否”),理由是F中物质不变蓝色;
②装置D(填上图中装置编号)中出现白色沉淀的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
(4)问题讨论
①电解CuCl2溶液阴极上除发生Cu2++2e-═Cu的反应外,还发生的反应为2Cu2++2e-+2Cl-=2CuCl;
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是氢气和氧气混合加热可能发生爆炸和空气中水蒸气会干扰Cu2O是否存在的判断.