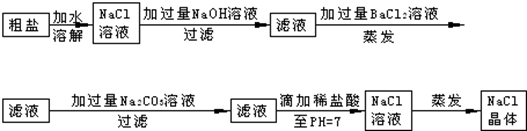
题目内容
20. 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.
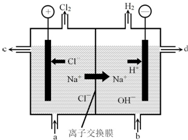
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.(一)如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
(1)写出电解饱和食盐水的离子方程式:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;
离子交换膜的作用为能得到纯度更高的氢氧化钠溶液、避免Cl2与H2反应(合理即给分).
(2)氯气与氢氧化钠可制取漂白液,室温下,0.1mol/L NaClO溶液的pH大于0.1mol/L Na2SO3溶液的pH(选填“大于”、“小于”或“等于”);
浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-).
已知:HClO Ka1=2.95×10-8
H2SO3 Ka1=1.54×10-2 Ka2=1.02×10-7
H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11
(二)氢气是一种极具发展潜力的清洁能源,以太阳能为热能,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图所示:

(3)反应I的化学方程式是SO2+I2+2H2O=2HI+H2SO4.
(4)反应Ⅱ:2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mol-1
它由两步反应组成:
i.H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ•mol-1
ii.SO3(g)分解.
①书写SO3(g)分解的热化学方程式2SO3(g)?2SO2(g)+O2(g)△H=+196kJ•mol-1.
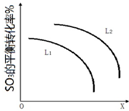
②L(Ll,L2),X可分别代表压强或温度,下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系.
X代表的物理量是压强;判断Ll,L2的大小关系L2>L1.
分析 (1)用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气、阴极上水得电子生成氢气和氢氧根离子;离子交换膜只有离子能通过,能防止氯气和碱反应、与氢气反应;
(2)H2SO3Ki1=1.54×10-2,Ki2=1.02×10-7,HClOKi1=2.95×10-8 ,说明ClO-水解程度大于SO32-;H2SO3Ki1=1.54×10-2 Ki2=1.02×10-7,H2CO3Ki1=4.3×10-7Ki2=5.6×10-11.说明SO32-水解程度小于CO32-;
(3)根据图知,SO2、I2、H2O是反应物,HI、H2SO4是生成物,根据反应物和生成物书写方程式;
(4)①a.2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mol-1
b.H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ•mol-1
将方程式a-2b得2SO3(g)?2SO2(g)+O2(g)焓变进行相应的改变;
②由图可知,X越大,转化率越低;
分解反应为吸热反应,温度高,转化率大.
解答 解:(1)用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气、阴极上水得电子生成氢气和氢氧根离子,电池反应式为2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;离子交换膜只有离子能通过,能防止氯气和碱反应、与氢气反应,
故答案为:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;能得到纯度更高的氢氧化钠溶液、避免Cl2与H2反应(合理即给分);
(2)H2SO3 Ki1=1.54×10-2,Ki2=1.02×10-7,HClOKi1=2.95×10-8 ,说明ClO-水解程度大于SO32-,0.1mol/L NaClO溶液的pH大于0.1mol/L Na2SO3溶液的pH,依据电离平衡常数大小比较,H2SO3Ki1=1.54×10-2 Ki2=1.02×10-7,H2CO3Ki1=4.3×10-7Ki2=5.6×10-11.说明SO32-水解程度小于CO32-,浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)c(HCO3-)>c(HSO3-),
故答案为:大于;c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);
(3)根据图知,SO2、I2、H2O是反应物,HI、H2SO4是生成物,根据反应物和生成物书写方程式为SO2+I2+2H2O=2HI+H2SO4,故答案为:SO2+I2+2H2O=2HI+H2SO4;
(4)①a.2H2SO4(l)═2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mol-1
b.H2SO4(l)═SO3(g)+H2O(g)△H=+177kJ•mol-1
将方程式a-2b得2SO3(g)?2SO2(g)+O2(g)△H=(+550kJ•mol-1
)-2(+177kJ•mol-1)=+196 kJ•mol-1,
故答案为:2SO3(g)?2SO2(g)+O2(g)△H=+196 kJ•mol-1;
②由图可知,X越大,转化率越低,升高温度转化率增大,则X表示压强;
由SO3(g)=SO2(g)+O2(g)△H>0,温度高,转化率大,图中等压强时L2对应的转化率大,则L1<L2,
故答案为:压强;L2>L1.
点评 本题考查电解原理、盖斯定律、图象分析,为高频考点,明确电解原理、盖斯定律及外界条件对化学平衡影响是解本题关键,侧重考查学生分析推断及计算能力,注意图象中曲线变化趋势与外界条件的关系,题目难度不大.

 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:| 温 度 | 200℃300℃400℃ |
| 平衡常数 | K1 K2 K3 |
(2)下列描述中能说明上述反应已达到平衡的是bd(填序号)
a.v(O2)正=2v(SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)在上述平衡体系中加入18O2,当平衡发生移动后,SO2中18O的百分含量增加(填增加、减少、不变)其原因是该反应是可逆反应,在SO2和18O2反应生成S18O3的同时,S18O3又分解生成S18O2.
(4)一定温度下,把2molSO2和1molO2通入一恒容密闭容器中,平衡时SO3的体积分数为x.保持温度不变,若初始加入的SO2、O2和SO3的物质的量分别为a、b、c,当a、b、c的取值满足下列关系时才能保证达到平衡时SO3的体积分数仍为x.
①a+c=2(填a与c的关系)、②2b+c=2(填b、c的关系).
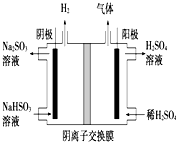
(5)工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阳极电极反应式4OH--4e-=2H2O+O2,阳极区逸出气体的成分为O2、SO2(填化学式).
| A. | 在0.1mol/L Na2CO3溶液中,CO32-的数目小于0.1NA个 | |
| B. | 标准状况下,6.0 g乙酸含有0.3 NA个C-H键 | |
| C. | 32gCu与足量硫黄充分反应,转移NA个电子 | |
| D. | 31g白磷(P4)中含有6 NA个共价键 |
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
Ⅰ.查阅资料:铜的化合物颜色性质如下
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证 取电解CuCl2溶液后的阴极石墨电极,洗涤、干燥,连接下列装置进行实验,验证阴极产物
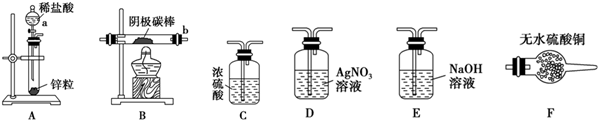
①实验前,检查装置A气密性的方法是将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗的活塞,水的液面不会连续下降,证明装置A的气密性好.
②实验时,各装置从左至右的连接顺序为A→E→C→B→F→D.(填装置代号)
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象
①碳棒上的红色物质是否有Cu2O否(填“是”或“否”),理由是F中物质不变蓝色;
②装置D(填上图中装置编号)中出现白色沉淀的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
(4)问题讨论
①电解CuCl2溶液阴极上除发生Cu2++2e-═Cu的反应外,还发生的反应为2Cu2++2e-+2Cl-=2CuCl;
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是氢气和氧气混合加热可能发生爆炸和空气中水蒸气会干扰Cu2O是否存在的判断.
 _.
_.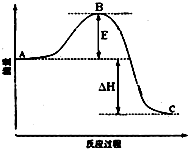 安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.
安徽金和上市公司近期新增硫酸生产线.其主要反应 为:2SO2(g)+O2(g)═2SO3(g),该反应过程的能量变化如图所示.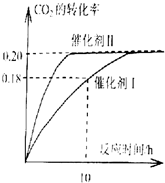 已知CO2可以生产绿色燃料甲醇,反应如下:
已知CO2可以生产绿色燃料甲醇,反应如下: