题目内容
下列说法正确的是( )
| A、0.1mol/L溶液中的(NH4)2SO4溶液中的c(NH4+)<c(SO42-) |
| B、相同温度下,0.6mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2:1 |
| C、向0.1mol/L NaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-) |
| D、向醋酸钠溶液中加入适量醋酸,使混合液pH=7,此时混合液中c(Na+)<c(CH3COO-) |
考点:盐类水解的应用,弱电解质在水溶液中的电离平衡,离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.硫酸铵为强酸弱碱盐,铵根离子水解,溶液呈酸性,根据电荷是判断;
B.弱电解质溶液中,浓度越大弱电解质电离程度越小;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
B.弱电解质溶液中,浓度越大弱电解质电离程度越小;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答:
解:A.硫酸铵为强酸弱碱盐,铵根离子水解,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(NH4+)+c(H+)=c(OH-)+2c(SO42-),所以c(NH4+)>c(SO42-),故A错误;
B.弱电解质溶液中,浓度越大弱电解质电离程度越小,相同温度下,0.6mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比小于2:1,故B错误;
C.溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(Na+)<c(NO3-),故C正确;
D.溶液呈中性,则c(H+)=c(OH-),任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)=c(CH3COO-),故D错误;
故选C.
B.弱电解质溶液中,浓度越大弱电解质电离程度越小,相同温度下,0.6mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比小于2:1,故B错误;
C.溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(Na+)<c(NO3-),故C正确;
D.溶液呈中性,则c(H+)=c(OH-),任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)=c(CH3COO-),故D错误;
故选C.
点评:本题考查了离子浓度大小比较,根据电解质溶液的酸碱性再结合电荷守恒、物料守恒来分析解答,易错选项是B,知道弱电解质溶液浓度与弱电解质电离程度的关系,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、甲苯是饱和烃,氯乙烯是不饱和烃 |
| B、石油的裂化产品能使溴水褪色 |
| C、蛋白质在CuSO4溶液中发生盐析 |
| D、油脂在NaOH溶液中水解生成高级脂肪酸和甘油 |
下列与有机物的结构、性质有关的叙述正确的是( )
| A、用新制氢氧化铜悬浊液无法鉴别葡萄糖和乙酸 |
| B、乙酸与乙醇可以发生酯化反应,又均可与碳酸氢钠溶液反应 |
| C、硫酸铵、硫酸铜和乙醇均能使蛋白质变性 |
| D、二氯甲烷不存在同分异构体 |
下列各组离子在指定环境中一定能大量共存的是( )
| A、在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42- |
| B、c(OH-)=10-13mol?L-1的溶液中:SO32-、CO32-、Na+、K+ |
| C、在含有大量Fe3+的溶液中:Cu2+、Cl-、NO3-、S2- |
| D、加入Mg能放出H2的溶液中:K+、NH4+、Cl-、SO42- |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4L SO3中含有的氧原子数为3NA |
| B、标准状况下,22.4L Cl2与足量的稀NaOH 溶液反应,转移电子总数为2NA |
| C、1mol N5+共有34NA核外电子 |
| D、0.5mol CCl4中含有共价键数目为4NA |
常温下,将0.01mol?L-1 Na2SO3溶液与0.01mol?L-1 KHSO3溶液等体积混合,若忽略混合后溶液的体积的变化,则下列判断正确的量( )
| A、混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-) |
| B、混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-) |
| C、混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol?L-1 |
| D、两溶液混合前,Na2SO3溶液中水电离出C(H+)小于KHSO3溶液中水电离出C(H+) |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法正确的是( )
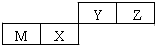
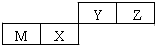
| A、原子半径Z>Y |
| B、X的最简单气态氢化物的热稳定性比Z的小 |
| C、Y的最高价氧化物对应水化物的酸性比X的弱 |
| D、M的最高价氧化物对应水化物不能与NaOH溶液反应 |
 火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的. 用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:
用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空: