题目内容
 用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:
用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:(1)所需浓H2SO4的体积为
(2)如果实验室有10mL、20mL、50mL量筒,应选用
(3)若实验中出现下列现象对所配溶液浓度有什么影响?
(填序号:A.偏高 B.偏低 C.无影响)
①浓硫酸溶解后未冷至室温即进行定容
②定容时俯视刻度线
③摇匀后静置,发现液面低于刻度线,继续滴加蒸馏水至刻度线
(4)如图是配制过程中转移溶液的示意图,图中有两处错误,分别是:①
②
(5)在500mL 0.5mol/LH2SO4溶液取出5mL该溶液,它的H+物质的量浓度为
(6)4g的氢氧化钠可以跟上述0.5mol/L的硫酸溶液
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(2)根据浓硫酸的体积选择量筒的规格;根据配制溶液的实验操作步骤选择所需仪器;
(3)根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(4)配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,配制多大体积的溶液要采用多大体积的容量瓶;
(5)溶液是均匀的,取出的氢离子浓度与原溶液中相等,为硫酸浓度的2倍;
(6)根据氢氧化钠与硫酸反应的化学方程式可判断反应中两物质的物质的量的关系,由此可计算需要0.5mol/L的硫酸的体积.
(2)根据浓硫酸的体积选择量筒的规格;根据配制溶液的实验操作步骤选择所需仪器;
(3)根据c=
| n |
| V |
(4)配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,配制多大体积的溶液要采用多大体积的容量瓶;
(5)溶液是均匀的,取出的氢离子浓度与原溶液中相等,为硫酸浓度的2倍;
(6)根据氢氧化钠与硫酸反应的化学方程式可判断反应中两物质的物质的量的关系,由此可计算需要0.5mol/L的硫酸的体积.
解答:
解:(1)根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,
解得:x≈13.6,所以应量取的浓硫酸体积是13.6mL,
故答案为:13.6;
(2)需浓硫酸的体积为13.6mL,所以需要选择20mL量筒;
配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、20mL量筒、500mL容量瓶;
故答案为:20;胶头滴管;
(3)①浓硫酸溶解后未冷至室温即进行定容,导致溶液的体积偏小,配制溶液的浓度偏高,
②定容时俯视刻度线,导致溶液的体积偏小,配制溶液的浓度偏高,
③摇匀后静置,发现液面低于刻度线,继续滴加蒸馏水至刻度线,导致溶液的体积偏大,配制溶液的浓度偏低;故答案为:A;A;B.
(4)配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,右图该同学在转移溶液时没有用玻璃棒引流,配制250mL的溶液要采用250mL的容量瓶,
故答案为:未用玻璃棒引流;容量瓶规格不对,未采用500 mL容量瓶;
(5)从中取出10mL,溶液是均匀的,取出的氢离子浓度与原溶液中相等,故c(H+)=2c(H2SO4)=2×0.5mol/L=1mol/L,故答案为1;
(6)设需要0.5mol/L的硫酸的物质的量为x
氢氧化钠的物质的量=
=0.1mol
H2SO4+2NaOH═Na2SO4+2H2O
1 2
x 0.1mol
x=0.05mol
需要0.5mol/L的硫酸的体积=0.05mol÷0.5mol/L=0.1L=100mL
故答案为:100.
解得:x≈13.6,所以应量取的浓硫酸体积是13.6mL,
故答案为:13.6;
(2)需浓硫酸的体积为13.6mL,所以需要选择20mL量筒;
配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、20mL量筒、500mL容量瓶;
故答案为:20;胶头滴管;
(3)①浓硫酸溶解后未冷至室温即进行定容,导致溶液的体积偏小,配制溶液的浓度偏高,
②定容时俯视刻度线,导致溶液的体积偏小,配制溶液的浓度偏高,
③摇匀后静置,发现液面低于刻度线,继续滴加蒸馏水至刻度线,导致溶液的体积偏大,配制溶液的浓度偏低;故答案为:A;A;B.
(4)配制一定物质的量浓度的溶液实验,在移液时,要用玻璃棒引流,右图该同学在转移溶液时没有用玻璃棒引流,配制250mL的溶液要采用250mL的容量瓶,
故答案为:未用玻璃棒引流;容量瓶规格不对,未采用500 mL容量瓶;
(5)从中取出10mL,溶液是均匀的,取出的氢离子浓度与原溶液中相等,故c(H+)=2c(H2SO4)=2×0.5mol/L=1mol/L,故答案为1;
(6)设需要0.5mol/L的硫酸的物质的量为x
氢氧化钠的物质的量=
| 4g |
| 40g/mol |
H2SO4+2NaOH═Na2SO4+2H2O
1 2
x 0.1mol
x=0.05mol
需要0.5mol/L的硫酸的体积=0.05mol÷0.5mol/L=0.1L=100mL
故答案为:100.
点评:本题考查了一定物质的量浓度溶液的配制,难度中等,根据c=
理解溶液配制原理与误差分析,注意浓硫酸的稀释操作.
| n |
| V |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、0.1mol/L溶液中的(NH4)2SO4溶液中的c(NH4+)<c(SO42-) |
| B、相同温度下,0.6mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2:1 |
| C、向0.1mol/L NaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-) |
| D、向醋酸钠溶液中加入适量醋酸,使混合液pH=7,此时混合液中c(Na+)<c(CH3COO-) |
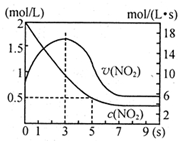 某绝热恒容容器中充入2mol/L NO2,发生反应2NO2?N2O4 △H=-56.9kJ/mol下列分析不正确的是( )
某绝热恒容容器中充入2mol/L NO2,发生反应2NO2?N2O4 △H=-56.9kJ/mol下列分析不正确的是( )| A、5s时NO2的转化率为75% |
| B、0-3s时v(NO2)增大是由于体系温度升高 |
| C、3s时化学反应处于平衡状态 |
| D、9s时再充入N2O4,平衡后K较第一次平衡时大 |
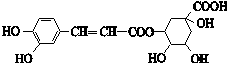 下列有关绿原酸(结构简式如图)的说法不正确的是( )
下列有关绿原酸(结构简式如图)的说法不正确的是( )| A、分子式为C16H18O9 |
| B、1mol绿原酸最多能与8mol NaOH反应 |
| C、1mol绿原酸最多能与4mol H2反应 |
| D、能发生取代反应、消去反应、加成反应和氧化反应 |
某溶液中可能含有下列5中离子中的某几种:Na+、NH4+、Mg2+、Al3+、Cl-.为确认该溶液组成进行如下实验:①取20.0ml该溶液,加入25.0ml4.00mol/LNaOH溶液,有白色沉淀、无刺激气味气体生成.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100ml,测得滤液中c(OH-)为0.20mol/L②另取20.0ml该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g由此可得出关于原溶液组成的正确结论是( )
| A、一定含Mg2+、Al3+、Cl-,不含Na+、NH4+ |
| B、一定含Na+、Mg2+、Cl-,不含NH4+,可能含有Al3+ |
| C、c(Cl-)为4.0mol/L,c(Al3+)为1.0mol/L |
| D、c(Mg2+)为1.0mol/L,c(Na+)为0.5mol/L |