题目内容
四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法正确的是( )
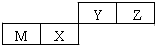
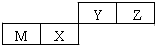
| A、原子半径Z>Y |
| B、X的最简单气态氢化物的热稳定性比Z的小 |
| C、Y的最高价氧化物对应水化物的酸性比X的弱 |
| D、M的最高价氧化物对应水化物不能与NaOH溶液反应 |
考点:位置结构性质的相互关系应用,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:四种短周期元素在周期表中的位置如图,其中只有M为金属元素,则M为Al,结合位置关系可知,X为Si,Y为N,Z为O,
A.电子层越多,原子半径越大;
B.非金属性越强,气态氢化物越稳定;
C.非金属性越强,对应的最高价氧化物的水化物酸性越强;
D.M的最高价氧化物对应水化物为Al(OH)3为两性氢氧化物.
A.电子层越多,原子半径越大;
B.非金属性越强,气态氢化物越稳定;
C.非金属性越强,对应的最高价氧化物的水化物酸性越强;
D.M的最高价氧化物对应水化物为Al(OH)3为两性氢氧化物.
解答:
解:四种短周期元素在周期表中的位置如图,其中只有M为金属元素,则M为Al,结合位置关系可知,X为Si,Y为N,Z为O,
A.X的电子层多,原子半径大,则原子半径为X>Y,故A错误;
B.非金属性Z>X,则X的最简单气态氢化物的热稳定性比Z的小,故B正确;
C.非金属性Y>X,Y的最高价氧化物对应水化物的酸性比X的强,故C错误;
D.M的最高价氧化物对应水化物为Al(OH)3为两性氢氧化物,能与NaOH溶液反应,故D错误;
故选B.
A.X的电子层多,原子半径大,则原子半径为X>Y,故A错误;
B.非金属性Z>X,则X的最简单气态氢化物的热稳定性比Z的小,故B正确;
C.非金属性Y>X,Y的最高价氧化物对应水化物的酸性比X的强,故C错误;
D.M的最高价氧化物对应水化物为Al(OH)3为两性氢氧化物,能与NaOH溶液反应,故D错误;
故选B.
点评:本题考查位置、结构及性质的应用,把握M为金属Al并推出各元素为解答的关键,注意元素周期律的应用及氢氧化铝的两性,题目难度不大.

练习册系列答案
相关题目
有机化合物A转化为B的反应如下,下列说法正确的是( )


| A、B的分子式为C16H14O2 |
| B、上述转化属于还原反应 |
| C、二者均为芳香烃 |
| D、二者均能发生加成、酯化反应 |
下列说法正确的是( )
| A、0.1mol/L溶液中的(NH4)2SO4溶液中的c(NH4+)<c(SO42-) |
| B、相同温度下,0.6mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2:1 |
| C、向0.1mol/L NaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-) |
| D、向醋酸钠溶液中加入适量醋酸,使混合液pH=7,此时混合液中c(Na+)<c(CH3COO-) |
以氧化铝为原料制取氢氧化铝,最好的方法是( )
| A、将氧化铝溶于水 |
| B、将氧化铝先溶于盐酸中,之后滴加氨水 |
| C、将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液 |
| D、将氧化铝溶于氢氧化钾 |
下列有关有机物的说法正确的是( )
| A、甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| B、米酒变酸的过程涉及了氧化反应 |
| C、乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 |
| D、淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应 |
化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
| B、绿色化学的核心是从源头上消除工业生产对环境的污染 |
| C、铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| D、华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 |
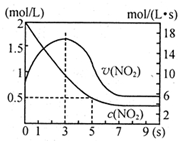 某绝热恒容容器中充入2mol/L NO2,发生反应2NO2?N2O4 △H=-56.9kJ/mol下列分析不正确的是( )
某绝热恒容容器中充入2mol/L NO2,发生反应2NO2?N2O4 △H=-56.9kJ/mol下列分析不正确的是( )| A、5s时NO2的转化率为75% |
| B、0-3s时v(NO2)增大是由于体系温度升高 |
| C、3s时化学反应处于平衡状态 |
| D、9s时再充入N2O4,平衡后K较第一次平衡时大 |
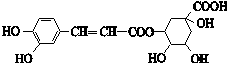 下列有关绿原酸(结构简式如图)的说法不正确的是( )
下列有关绿原酸(结构简式如图)的说法不正确的是( )| A、分子式为C16H18O9 |
| B、1mol绿原酸最多能与8mol NaOH反应 |
| C、1mol绿原酸最多能与4mol H2反应 |
| D、能发生取代反应、消去反应、加成反应和氧化反应 |
