题目内容
 火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳.将CO2转化为甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
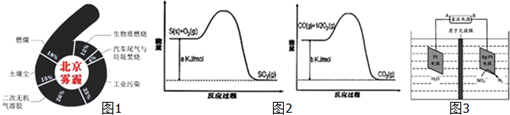
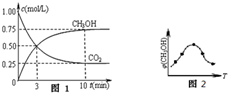
①在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.回答:0~10min内,氢气的平均反应速率为
②取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3
(3)脱硫.利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当溶液呈中性时,离子浓度关系正确的是(选填字母):
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
考点:物质的量或浓度随时间的变化曲线,热化学方程式,化学平衡建立的过程,化学平衡的影响因素,离子浓度大小的比较
专题:基本概念与基本理论
分析:(1)根据盖斯定律,利用已知化学反应方程式乘以某个系数相加或相减,构造出目标化学反应方程式,该化学反应的焓变即为已知化学反应方程式的焓变乘以某个系数相加或相减得到;
(2)①先根据图表,利用v=
计算v(CO2),再利用各物质的反应速率之比等于计量数之比,确定v(H2);该温度下该反应的K=
,并据此判断;
②到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,据此判断;
(3)①由表格中的数据可知,HSO3-越多,酸性越强,则电离生成氢离子;
②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,结合电荷守恒解答.
(2)①先根据图表,利用v=
| △c |
| △t |
| c(CH3OH)平衡c(H2O)平衡 |
| c(CO2)平衡c3(H2)平衡 |
②到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,据此判断;
(3)①由表格中的数据可知,HSO3-越多,酸性越强,则电离生成氢离子;
②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,结合电荷守恒解答.
解答:
解:(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加,可得
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol,
故答案为:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol;
(2)①由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,所以10min内,v(CO2)=
=
=0.075mol/(L?min),反应速率之比等于计量数之比,故v(H2)=3v(CO2)=3×0.075mol/(L?min)=0.225mol/(L?min),
∵根据图象可知:c(CO2)平衡=0.25mol/L,c(CH3OH)平衡=0.75mol/L,因为CO2的起始浓度为1mol/L而加入的物质的量为1mol,所以可知容器的体积为1L,再根据反应CO2(g)+3H2(g) CH3OH(g)+H2O可求得,c(H2)平衡=
CH3OH(g)+H2O可求得,c(H2)平衡=
-3×0.75=0.75mol/L,c(H2O)平衡=c(CH3OH)平衡=0.75mol/L,
该温度下该反应的K=
=
=
,保持温度不变,向该密闭容器中再充入1mol CO2(g)和1mol H2O(g)时,比值
=
=
<
,所以平衡要向正反应方向移动,
故答案为:0.225;正向;
②由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,故答案为:<;
(3)①由表格中的数据可知,溶液呈酸性,HSO3-越多,酸性越强,是因为溶液中存在:HSO3- ?SO32-+H+; HSO3-+H2O
?SO32-+H+; HSO3-+H2O ?H2SO3+OH-电离程度大于水解程度,溶液显酸性,
?H2SO3+OH-电离程度大于水解程度,溶液显酸性,
故答案为:酸;溶液中存在:HSO3- ?SO32-+H+; HSO3-+H2O
?SO32-+H+; HSO3-+H2O ?H2SO3+OH-电离程度大于水解程度,故溶液显酸性;
?H2SO3+OH-电离程度大于水解程度,故溶液显酸性;
②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,
a.由电荷守恒可知,c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)=c(OH-),则c(Na+)=2c(SO32-)+c(HSO3-),故a正确;
b.SO32-+H2O?HSO3-+OH-,HSO3-?H++SO32-,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故b正确;
c.电荷守恒式为c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故c错误;
故答案为:ab.
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol,
故答案为:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol;
(2)①由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,所以10min内,v(CO2)=
| △c(CO2) |
| △t |
| 0.75mol/L |
| 10min |
∵根据图象可知:c(CO2)平衡=0.25mol/L,c(CH3OH)平衡=0.75mol/L,因为CO2的起始浓度为1mol/L而加入的物质的量为1mol,所以可知容器的体积为1L,再根据反应CO2(g)+3H2(g)
 CH3OH(g)+H2O可求得,c(H2)平衡=
CH3OH(g)+H2O可求得,c(H2)平衡=| 3mol |
| 1L |
该温度下该反应的K=
| c(CH3OH)平衡c(H2O)平衡 |
| c(CO2)平衡c3(H2)平衡 |
| 0.75mol/L×0.75mol/L |
| 0.25mol/L×(0.75mol/L)3 |
| 16 |
| 3 |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 0.75mol/L×1.75mol/L |
| 1.25mol/L×(0.75mol/L)3 |
| 112 |
| 45 |
| 16 |
| 3 |
故答案为:0.225;正向;
②由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,故答案为:<;
(3)①由表格中的数据可知,溶液呈酸性,HSO3-越多,酸性越强,是因为溶液中存在:HSO3-
 ?SO32-+H+; HSO3-+H2O
?SO32-+H+; HSO3-+H2O ?H2SO3+OH-电离程度大于水解程度,溶液显酸性,
?H2SO3+OH-电离程度大于水解程度,溶液显酸性,故答案为:酸;溶液中存在:HSO3-
 ?SO32-+H+; HSO3-+H2O
?SO32-+H+; HSO3-+H2O ?H2SO3+OH-电离程度大于水解程度,故溶液显酸性;
?H2SO3+OH-电离程度大于水解程度,故溶液显酸性;②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,
a.由电荷守恒可知,c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)=c(OH-),则c(Na+)=2c(SO32-)+c(HSO3-),故a正确;
b.SO32-+H2O?HSO3-+OH-,HSO3-?H++SO32-,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故b正确;
c.电荷守恒式为c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故c错误;
故答案为:ab.
点评:本题以化石燃料载体,考查了盖斯定律、化学平衡移动的判断,电解质溶液中离子浓度大小的比较,综合性较强,对学生分析问题解决问题的能力要求较高,试题较难.

练习册系列答案
相关题目
铋(Bi)在医药方面有重要应用,下列关于
Bi和
Bi的说法正确的是( )
209 83 |
210 83 |
| A、两者互为同素异形体 | ||||
B、
| ||||
C、
| ||||
| D、两者分别含有126和127个质子 |
以下性质的比较可能错误的是( )
| A、离子半径 H->Li+ |
| B、熔点 Al2O3>MgO |
| C、结合质子(H+)的能力 CO32->ClO- |
| D、密度 1-氯戊烷>1-氯己烷 |
现有X、Y、Z三种常见短周期元素,Y、Z为同周期金属元素,且X和Y的某种化合物为淡黄色固体M,Y、Z的最高价氧化物对应的水化物可以反应生成盐N和水.下列说法不正确的是( )
| A、固体M能与水反应生成X单质和一种强碱 |
| B、Z单质的薄片在酒精灯上加热能熔化,但不滴落 |
| C、Y的最高价氧化物对应的水化物和盐N均能抑制水的电离 |
| D、M和N中均含有离子键和共价键 |
有机化合物A转化为B的反应如下,下列说法正确的是( )


| A、B的分子式为C16H14O2 |
| B、上述转化属于还原反应 |
| C、二者均为芳香烃 |
| D、二者均能发生加成、酯化反应 |
下列说法正确的是( )
| A、0.1mol/L溶液中的(NH4)2SO4溶液中的c(NH4+)<c(SO42-) |
| B、相同温度下,0.6mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2:1 |
| C、向0.1mol/L NaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-) |
| D、向醋酸钠溶液中加入适量醋酸,使混合液pH=7,此时混合液中c(Na+)<c(CH3COO-) |