题目内容
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4L SO3中含有的氧原子数为3NA |
| B、标准状况下,22.4L Cl2与足量的稀NaOH 溶液反应,转移电子总数为2NA |
| C、1mol N5+共有34NA核外电子 |
| D、0.5mol CCl4中含有共价键数目为4NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.根据标准状况下三氧化硫为固体进行分析;
B.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂,也是还原剂,1mol氯气完全反应转移1mol电子;
C.根据 一个N5+共有34个核外电子判断;
D.根据1个 CCl4分子中含有4个共价键判断.
B.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂,也是还原剂,1mol氯气完全反应转移1mol电子;
C.根据 一个N5+共有34个核外电子判断;
D.根据1个 CCl4分子中含有4个共价键判断.
解答:
解:A.在标准状况下,三氧化硫为固体,题中条件无法计算22.4LSO3的物质的量,故A错误;
B.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂,也是还原剂,1mol氯气完全反应转移1mol电子,标准状况下,22.4L Cl2与足量的稀NaOH 溶液反应,转移电子总数为NA,故B错误;
C.一个N5+共有34个核外电子,1molN5+共有34NA核外电子,故C正确;
D.1个 CCl4中含有4个共价键,0.5mol CCl4中含有共价键数目为2NA,故D错误;
故选C.
B.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂,也是还原剂,1mol氯气完全反应转移1mol电子,标准状况下,22.4L Cl2与足量的稀NaOH 溶液反应,转移电子总数为NA,故B错误;
C.一个N5+共有34个核外电子,1molN5+共有34NA核外电子,故C正确;
D.1个 CCl4中含有4个共价键,0.5mol CCl4中含有共价键数目为2NA,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意标准状况下三氧化硫等不是气体,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
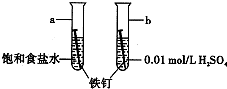 如图是研究铁钉腐蚀的装置图.下列说法不正确的是( )
如图是研究铁钉腐蚀的装置图.下列说法不正确的是( )| A、ab在两处的腐蚀速率a<b |
| B、a、b两处铁钉中的碳均为正极 |
| C、a、b两处铁钉中的铁均失电子被氧化 |
| D、a、b两处的正极反应式均为O2+4e-+4H+═2H2O |
下列说法正确的是( )
| A、有化学键断裂的过程一定发生化学变化 | ||
| B、氯化钠是一种电解质,电解饱和食盐水可制得金属钠 | ||
C、将pH=a的醋酸稀释为pH=a+1的过程中,
| ||
| D、SiO2是酸性氧化物,能与强碱溶液反应,但不与任何酸反应 |
下列说法正确的是( )
| A、0.1mol/L溶液中的(NH4)2SO4溶液中的c(NH4+)<c(SO42-) |
| B、相同温度下,0.6mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2:1 |
| C、向0.1mol/L NaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-) |
| D、向醋酸钠溶液中加入适量醋酸,使混合液pH=7,此时混合液中c(Na+)<c(CH3COO-) |
以氧化铝为原料制取氢氧化铝,最好的方法是( )
| A、将氧化铝溶于水 |
| B、将氧化铝先溶于盐酸中,之后滴加氨水 |
| C、将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液 |
| D、将氧化铝溶于氢氧化钾 |
化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
| B、绿色化学的核心是从源头上消除工业生产对环境的污染 |
| C、铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| D、华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 |