题目内容
下列各组离子在指定环境中一定能大量共存的是( )
| A、在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42- |
| B、c(OH-)=10-13mol?L-1的溶液中:SO32-、CO32-、Na+、K+ |
| C、在含有大量Fe3+的溶液中:Cu2+、Cl-、NO3-、S2- |
| D、加入Mg能放出H2的溶液中:K+、NH4+、Cl-、SO42- |
考点:离子共存问题
专题:离子反应专题
分析:A.由水电离出的c(H+)=1×10-12mol/L的溶液为酸性或者碱性溶液,亚铁离子能够与次氯酸根离子反应,亚铁离子能够与氢氧根离子反应、次氯酸根离子能够与氢离子反应;
B.c(OH-)=10-13mol?L-1的溶液为酸性溶液,亚硫酸根离子、碳酸根离子能够与氢离子反应;
C.铁离子能够氧化硫离子、铁离子与硫离子反应生成硫化铜沉淀;
D.加入Mg能放出H2的溶液为酸性溶液,K+、NH4+、Cl-、SO42-离子之间不发生反应.
B.c(OH-)=10-13mol?L-1的溶液为酸性溶液,亚硫酸根离子、碳酸根离子能够与氢离子反应;
C.铁离子能够氧化硫离子、铁离子与硫离子反应生成硫化铜沉淀;
D.加入Mg能放出H2的溶液为酸性溶液,K+、NH4+、Cl-、SO42-离子之间不发生反应.
解答:
解:A.该溶液为酸性或者碱性溶液,Fe2+、ClO-之间能够发生反应,Fe2+能够与氢氧根离子、ClO-能够与氢离子发生反应,在溶液中不能大量共存,故A错误;
B.该溶液为酸性溶液,SO32-、CO32-能够与氢离子发生反应,在溶液中不能大量共存,故B错误;
C.Cu2+、S2-之间能够反应生成硫化铜沉淀,Fe3+、S2-之间能够发生反应,在溶液中不能大量共存,故C错误;
D.该溶液为酸性溶液,溶液中存在大量的氢离子,K+、NH4+、Cl-、SO42-之间不反应,也不与氢离子反应,在溶液中能够大量共存,故D正确;
故选D.
B.该溶液为酸性溶液,SO32-、CO32-能够与氢离子发生反应,在溶液中不能大量共存,故B错误;
C.Cu2+、S2-之间能够反应生成硫化铜沉淀,Fe3+、S2-之间能够发生反应,在溶液中不能大量共存,故C错误;
D.该溶液为酸性溶液,溶液中存在大量的氢离子,K+、NH4+、Cl-、SO42-之间不反应,也不与氢离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评:本题考查离子共存的正误判断,该题是高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能生成难溶物的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
常温时,下列叙述正确的是( )
| A、pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+) |
| B、pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的10倍 |
| C、AgCl在0.1mol/L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同 |
| D、1mL 1mol?L-1 Na2CO3溶液加水稀释至100mL,pH和Kw均减小 |
金属材料有着广泛的应用.下列说法错误的是( )
| A、用热碱液清洗铝材表面的油污时,会有气泡冒出 |
| B、电解精炼铜,电解结束后电解液浓度不变 |
| C、Fe2+、H+、NO3-三者不共存的原因为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
| D、硬铝是以铝为主要合金元素的合金材料,其熔点低于纯铝 |
下列说法正确的是( )
| A、0.1mol/L溶液中的(NH4)2SO4溶液中的c(NH4+)<c(SO42-) |
| B、相同温度下,0.6mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2:1 |
| C、向0.1mol/L NaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-) |
| D、向醋酸钠溶液中加入适量醋酸,使混合液pH=7,此时混合液中c(Na+)<c(CH3COO-) |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
| B、在0.1mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | ||
| C、在0.1mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
D、在
|
下列有关有机物的说法正确的是( )
| A、甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| B、米酒变酸的过程涉及了氧化反应 |
| C、乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 |
| D、淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应 |
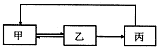 下表中各组物质之间不能通过一步反应实现如图转化的是( )
下表中各组物质之间不能通过一步反应实现如图转化的是( )