题目内容
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图Ⅰ表示200℃时容器中各物质的量随时间的变化关系,图Ⅱ表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )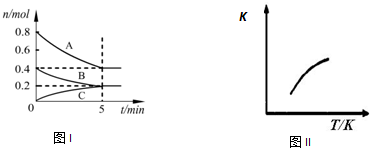

| A、200℃时,反应从开始到平衡的平均速率v(A)=0.08 mol?L-1?min-1 |
| B、若0~5 min时容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol |
| C、200℃时,若在第6 min再向体系中加入催化剂,可使v正>v逆 |
| D、200℃时,平衡后再充入2 mol C,则达到平衡时,化学平衡常数变小 |
考点:化学平衡的计算
专题:
分析:A.根据v=
计算反应速率;
B.根据反应物减小,生成物增加,变化的物质的量之比等于反应中计量数之比,写出化学方程式,根据图Ⅱ可知,温度升高,平衡常数增大,说明正反应为吸热反应;
C.催化剂只能改变反应速率,不能改变平衡状态,所以平衡不移动,v正、v逆同时增大;
D.在容器中加入C,因为以为全部的生成物,所以可以假设C在另一容器中建立与原平衡等效的化学平衡,然后再加入原体系,相当于对原容器加压,平衡向体积减小的方向移动,化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,仅与温度有关,与浓度无关.
| △c |
| t |
B.根据反应物减小,生成物增加,变化的物质的量之比等于反应中计量数之比,写出化学方程式,根据图Ⅱ可知,温度升高,平衡常数增大,说明正反应为吸热反应;
C.催化剂只能改变反应速率,不能改变平衡状态,所以平衡不移动,v正、v逆同时增大;
D.在容器中加入C,因为以为全部的生成物,所以可以假设C在另一容器中建立与原平衡等效的化学平衡,然后再加入原体系,相当于对原容器加压,平衡向体积减小的方向移动,化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,仅与温度有关,与浓度无关.
解答:
解:A.根据图中数据,结合v=
计算反应速率v(A)=
mol?L-1?min-1=0.04mol?L-1?min-1,故A错误;
B.根据图可知A物质的量减小0.4mol,B物质的量减小0.2mol,A、B均为反应物,C物质的量增加0.2mol,为生成物,根据变化的物质的量之比等于反应中计量数之比,写出化学方程式为2A(g)+B(g)?C(g),根据图Ⅱ可知,温度升高,平衡常数增大,说明正反应为吸热反应,A变化了0.4mol,热量变化了mKJ,所以2molA反应时,吸收5mKJ,所以热化学方程式为2A(g)+B(g)?C(g)△H=+5m kJ/mol,故B正确;
C.催化剂只能改变反应速率,不能改变平衡状态,200℃时,若在第6 min再向体系中加入催化剂,平衡不移动,v正=v逆但同时增大,故C错误;
D.在容器中加入C,因为以为全部的生成物,所以可以假设C在另一容器中建立与原平衡等效的化学平衡,然后再加入原体系,相当于对原容器加压,平衡向体积减小的方向移动,对于反应2A(g)+B(g)?C(g),平衡向正反应方向移动,C的体积分数增大,但温度不变,化学平衡常数不变,故D错误;
故选B.
| △c |
| t |
| ||
| 5 |
B.根据图可知A物质的量减小0.4mol,B物质的量减小0.2mol,A、B均为反应物,C物质的量增加0.2mol,为生成物,根据变化的物质的量之比等于反应中计量数之比,写出化学方程式为2A(g)+B(g)?C(g),根据图Ⅱ可知,温度升高,平衡常数增大,说明正反应为吸热反应,A变化了0.4mol,热量变化了mKJ,所以2molA反应时,吸收5mKJ,所以热化学方程式为2A(g)+B(g)?C(g)△H=+5m kJ/mol,故B正确;
C.催化剂只能改变反应速率,不能改变平衡状态,200℃时,若在第6 min再向体系中加入催化剂,平衡不移动,v正=v逆但同时增大,故C错误;
D.在容器中加入C,因为以为全部的生成物,所以可以假设C在另一容器中建立与原平衡等效的化学平衡,然后再加入原体系,相当于对原容器加压,平衡向体积减小的方向移动,对于反应2A(g)+B(g)?C(g),平衡向正反应方向移动,C的体积分数增大,但温度不变,化学平衡常数不变,故D错误;
故选B.
点评:本题主要考查了化学反应速率的计算、热化学方程式的书写、影响平衡移动的因素等知识点,题目难度中等,注意D选项平衡向正反应方向移动,C的体积分数增大,温度不变,化学平衡常数不变为易错点.

练习册系列答案
相关题目
下列说法正确的是( )
| A、盐溶液都是中性的 |
| B、盐溶液的酸碱性与盐的类型无关 |
| C、NaHCO3溶液显酸性 |
| D、碳酸钠溶液显碱性,溶液中c(OH-)>c(H+) |
25℃时,水的电离达到平衡:H2O?H++OH-△H>0,下列叙述正确的是( )
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| C、向水中加入氯化钠溶液,c(H+)不变,n(H+)变大 |
| D、将水加热,Kw增大,pH不变 |
下列分散系能产生丁达尔效应的是( )
| A、硫酸铜溶液 | B、稀硫酸 |
| C、石灰浆 | D、氢氧化铁胶体 |
下列离子方程式书写正确的是( )
| A、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、盐酸与澄清石灰水反应:H++OH-═H2O |
| C、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、二氧化碳通入足量的氢氧化钠溶液:CO2+OH-═HCO3- |