题目内容
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
(1)从甲组情况分析,如何判断HA是强酸还弱酸?
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 .
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 .
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)= mol/L.
(Ⅱ)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B═H++HB- HB-??Η++B2-回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 .
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=2c(Na+)
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(6)下表为几种酸的电离平衡常数
则PH相同的CH3COONa、Na2CO3、NaHS溶液物质的量浓度由大到小的顺序
少量的CO2通入NaHS溶液中的反应的离子方程式 .
| 实验 编号 | HA的物质的量浓度(mol?L-1) | NaOH的物质的量浓度(mol?L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=
(Ⅱ)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B═H++HB- HB-??Η++B2-回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=2c(Na+)
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(6)下表为几种酸的电离平衡常数
| CH3COOH | H2CO3 | H2S |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
少量的CO2通入NaHS溶液中的反应的离子方程式
考点:弱电解质在水溶液中的电离平衡,盐类水解的原理
专题:
分析:(I)(1)等物质的量混合时,二者恰好反应生成盐,根据溶液的pH判断酸性强弱;
(2)任何溶液中都存在电荷守恒,根据电荷守恒判断;
(3)混合溶液的溶质为等物质的量的HA和NaA,pH>7说明A-的水解大于HA的电离,结合电荷守恒判断;
(4)由电荷守恒关系式变形得c(Na+)-c(A-)=c(OH-)-c(H+);
(II)(5)根据二元酸的电离方程式知,B2-只发生第一步水解,结合电荷守恒和物料守恒分析解答;
(6)弱酸的电离平衡常数越大,其酸性越强,酸性强的酸可以制取酸性弱的酸,弱酸的酸性越弱,其酸根离子的水解程度越大,据此分析.
(2)任何溶液中都存在电荷守恒,根据电荷守恒判断;
(3)混合溶液的溶质为等物质的量的HA和NaA,pH>7说明A-的水解大于HA的电离,结合电荷守恒判断;
(4)由电荷守恒关系式变形得c(Na+)-c(A-)=c(OH-)-c(H+);
(II)(5)根据二元酸的电离方程式知,B2-只发生第一步水解,结合电荷守恒和物料守恒分析解答;
(6)弱酸的电离平衡常数越大,其酸性越强,酸性强的酸可以制取酸性弱的酸,弱酸的酸性越弱,其酸根离子的水解程度越大,据此分析.
解答:
解:(1)若HA是强酸,恰好与NaOH溶液反应生成强酸强碱盐,pH=7;若HA是弱酸,生成的NaA水解显碱性,pH>7,故答案为:a=7时,HA是强酸(a>7时,HA是弱酸);
(2)混合溶液中存在电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),由于pH=7,则c(Na+)=c(A-),故答案为:C;
(3)混合溶液的溶质为等物质的量的HA和NaA,pH>7说明A-的水解大于HA的电离,所以离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(4)由电荷守恒关系式变形得c(Na+)-c(A-)=c(OH-)-c(H+)=(10-4-10-10)mol?L-1,故答案为:10-4-10-10;
(5)在Na2B中存在水解平衡:B2-+H2O=HB-+OH-,HB-不会进一步水解,所以溶液中没有H2B分子,
A.根据物料守恒得c(B2-)+c(HB-)=0.1mol?L-1,故A正确;
B.HB-不会进一步水解,所以溶液中没有H2B分子,故B错误;
C.根据质子守恒得c(OH-)=c(H+)+c(HB-),故C正确;
D.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-),故D错误;
故答案为:AC;
(6)据其电离平衡常数的数值判断,相同温度下,酸的强弱酸性是:CH3COOH>H2CO3>H2S>HCO3->HS-,酸根离子水解程度大小顺序是:S2->CO32->HS->HCO3->CH3COO-,相同浓度的钠盐溶液中,酸根离子水解程度越大其溶液的pH越大,当pH相等时,其浓度关系为:c(CH3COOH)>c(NaHS)>c(Na2CO3);酸性H2CO3>H2S>HCO3-,所以少量的CO2通入NaHS溶液中可以发生反应,离子反应为CO2+HS-=H2S+HCO3-,
故答案为:c(CH3COOH)>c(NaHS)>c(Na2CO3);CO2+HS-=H2S+HCO3-.
(2)混合溶液中存在电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),由于pH=7,则c(Na+)=c(A-),故答案为:C;
(3)混合溶液的溶质为等物质的量的HA和NaA,pH>7说明A-的水解大于HA的电离,所以离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(4)由电荷守恒关系式变形得c(Na+)-c(A-)=c(OH-)-c(H+)=(10-4-10-10)mol?L-1,故答案为:10-4-10-10;
(5)在Na2B中存在水解平衡:B2-+H2O=HB-+OH-,HB-不会进一步水解,所以溶液中没有H2B分子,
A.根据物料守恒得c(B2-)+c(HB-)=0.1mol?L-1,故A正确;
B.HB-不会进一步水解,所以溶液中没有H2B分子,故B错误;
C.根据质子守恒得c(OH-)=c(H+)+c(HB-),故C正确;
D.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-),故D错误;
故答案为:AC;
(6)据其电离平衡常数的数值判断,相同温度下,酸的强弱酸性是:CH3COOH>H2CO3>H2S>HCO3->HS-,酸根离子水解程度大小顺序是:S2->CO32->HS->HCO3->CH3COO-,相同浓度的钠盐溶液中,酸根离子水解程度越大其溶液的pH越大,当pH相等时,其浓度关系为:c(CH3COOH)>c(NaHS)>c(Na2CO3);酸性H2CO3>H2S>HCO3-,所以少量的CO2通入NaHS溶液中可以发生反应,离子反应为CO2+HS-=H2S+HCO3-,
故答案为:c(CH3COOH)>c(NaHS)>c(Na2CO3);CO2+HS-=H2S+HCO3-.
点评:本题考查了弱电解质的电离、离子浓度大小的比较,明确弱电解质电离特点结合物料守恒、电荷守恒和质子守恒来分析解答解答,注意(5)中HB-不水解,为易错点.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图Ⅰ表示200℃时容器中各物质的量随时间的变化关系,图Ⅱ表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )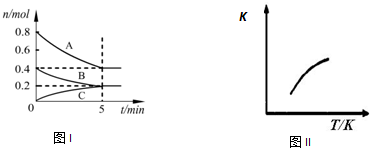

| A、200℃时,反应从开始到平衡的平均速率v(A)=0.08 mol?L-1?min-1 |
| B、若0~5 min时容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol |
| C、200℃时,若在第6 min再向体系中加入催化剂,可使v正>v逆 |
| D、200℃时,平衡后再充入2 mol C,则达到平衡时,化学平衡常数变小 |
已知常温下,AgBr的Ksp=4.9×10-13 mol2?L-2、AgI的Ksp=8.3×10-17 mol2?L-2 下列说法正确的是( )
| A、在常温下AgI水溶液中,Ag+和I-浓度的乘积是一个常数 |
| B、在常温下,在任何含AgI固体的溶液中,c(Ag+)=c(I-)且Ag+与I-浓度的乘积等于8.3×10-17 mol2?L-2 |
| C、常温下,将1mL 1.0×10-2 mol/L的KI与AgNO3溶液等体积混合,则生成AgI沉淀所需AgNO3溶液的最小浓度为3.32×10-14mol/L |
| D、向AgI饱和溶液中加入AgBr固体,c(I-)不变,Ksp值不变 |
下列溶液中各微粒的浓度关系正确的是( )
| A、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH4+大小顺序为①>②>③ |
| B、pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
| C、0.2 mol?L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| D、0.2 mol?L-1 HCl与0.1 mol?L-1 NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq)+OH-(aq)?F-(aq)+H2O(l)△H=-67.7kJ/mol
H+(aq)+OH-(aq)?H2O(l)△H=-57.3kJ/mol
在10mL 0.1mol/L的NaOH溶液中,加入10mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是( )
HF(aq)+OH-(aq)?F-(aq)+H2O(l)△H=-67.7kJ/mol
H+(aq)+OH-(aq)?H2O(l)△H=-57.3kJ/mol
在10mL 0.1mol/L的NaOH溶液中,加入10mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是( )
| A、当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) |
| B、水电离的热化学方程式为:H2O(1)?H+(aq)+OH-(aq)△H=+57.3kJ/mol |
| C、当c>0.1时,一定不存在:c(Na+)=c(F-) |
| D、若混合后溶液中:c(Na+)>c(OH-)>c(F-)>c(H+),则c一定小于0.1 |
能说明苯环使羟基变得活泼的事实是( )
| A、苯酚能和溴水迅速反应 |
| B、液态苯酚能与钠反应放出氢气 |
| C、室温时苯酚不易溶解于水 |
| D、苯酚具有极弱酸性 |