题目内容
进入秋冬季节后,郑州市频现雾霾天气,给人们的出行带来极大的不便和危害,人们“谈霾色变”.目前郑州市汽车保有量达230万量,汽车尾气的污染是引起雾霾的主要因素之一,NO和CO是汽车尾气的主要污染物.
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)?SO3(g)+NO(g)将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 .
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
(2)气缸中生成NO的反应为:N2(g)+O2(g)=2NO(g)△H>0,汽车启动后,气缸温度越高,
单位时间内NO排放量越大,原因是 .假设空气中N2和O2的体积比为4:1,1300℃时,1mol空气在某密闭容器内反应达到平衡时,测得NO为8×10-4mol,该反应的平衡常数K≈ .
(3)汽车燃油不完全燃烧时生成CO,有人设想按下列反应除去CO:2CO(g)=C(s)+O2(g)
△H>0,该设想能否实现? (填“能”或“不能”),原因是 .
(4)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,用化学方程式表示其原理: .
(5)某科研机构设计传感器检测CO的含量,其工作原理示意图如下:
Pt电极上发生的是 反应(填“氧化”或“还原”);
写出NiO电极的电极反应式 .

(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)?SO3(g)+NO(g)将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
(2)气缸中生成NO的反应为:N2(g)+O2(g)=2NO(g)△H>0,汽车启动后,气缸温度越高,
单位时间内NO排放量越大,原因是
(3)汽车燃油不完全燃烧时生成CO,有人设想按下列反应除去CO:2CO(g)=C(s)+O2(g)
△H>0,该设想能否实现?
(4)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,用化学方程式表示其原理:
(5)某科研机构设计传感器检测CO的含量,其工作原理示意图如下:
Pt电极上发生的是
写出NiO电极的电极反应式

考点:化学平衡的计算,原电池和电解池的工作原理,化学平衡状态的判断
专题:
分析:(1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)反应是 吸热反应,升温平衡正向进行;结合化学平衡 三段式列式计算平衡常数=
;
(3)根据G=△H-T?△S判断反应能否自发进行;
(4)根据生成物为氮气和二氧化碳书写;
(5)得电子的物质发生还原反应;NiO电极上NO失电子和氧离子反应生成二氧化氮.
(2)反应是 吸热反应,升温平衡正向进行;结合化学平衡 三段式列式计算平衡常数=
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
(3)根据G=△H-T?△S判断反应能否自发进行;
(4)根据生成物为氮气和二氧化碳书写;
(5)得电子的物质发生还原反应;NiO电极上NO失电子和氧离子反应生成二氧化氮.
解答:
解:(1)NO2(g)+SO2(g)?SO3(g)+NO(g),反应是气体体积不变的反应;
a、体系的压强始终不变,故不能说明达平衡状态,故a错误;
b、混合气体颜色保持不变,说明正逆反应速率相等,故b正确;
c、SO3和NO的体积比,始终保持不变,故c错误;
d、每消耗1molSO2的同时生成1molNO,只要反应发生一直符合这一关系,故d错误;
故答案为:b;
(2)气缸中生成NO的反应为:N2(g)+O2(g)=2NO(g)△H>0,汽车启动后,气缸温度越高,平衡正向进行,单位时间内NO排放量越大;
假设空气中N2和O2的体积比为4:1,1300℃时,1mol空气在某密闭容器内反应达到平衡时,测得NO为8×10-4mol,
N2(g)+O2(g)=2NO(g)
起始量(mol) 0.8 0.2 0
变化量(mol) 4×10-4 4×10-4 8×10-4
平衡量(mol)≈0.8≈0.2 8×10-4
反应前后气体体积不变,利用物质的量代替平衡浓度计算该反应的平衡常数K=
=4×10-6;
故答案为:升温,生成NO的速率加快,且平衡正向移动;4×10-6;
(3)2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应,任何温度下均不能自发进行,根据G=△H-T?△S,G>0,不能实现,
故答案为:不能;△H>0△S<0,所以△H-T△S<0;
(4)汽车尾气系统中装置反应的化学方程式为2CO+2NO
2CO2+N2,故答案为:2NO+2CO
N2+CO2 ;
(5)铂电极上氧气得电子生成氧离子而被还原,NiO电极上CO失电子和氧离子反应生成二氧化碳,所以电极反应式为CO+O2--2e-=CO2,
故答案为:还原;CO-2e-+O2-=CO2.
a、体系的压强始终不变,故不能说明达平衡状态,故a错误;
b、混合气体颜色保持不变,说明正逆反应速率相等,故b正确;
c、SO3和NO的体积比,始终保持不变,故c错误;
d、每消耗1molSO2的同时生成1molNO,只要反应发生一直符合这一关系,故d错误;
故答案为:b;
(2)气缸中生成NO的反应为:N2(g)+O2(g)=2NO(g)△H>0,汽车启动后,气缸温度越高,平衡正向进行,单位时间内NO排放量越大;
假设空气中N2和O2的体积比为4:1,1300℃时,1mol空气在某密闭容器内反应达到平衡时,测得NO为8×10-4mol,
N2(g)+O2(g)=2NO(g)
起始量(mol) 0.8 0.2 0
变化量(mol) 4×10-4 4×10-4 8×10-4
平衡量(mol)≈0.8≈0.2 8×10-4
反应前后气体体积不变,利用物质的量代替平衡浓度计算该反应的平衡常数K=
| 8×10-4 |
| 0.8×0.2 |
故答案为:升温,生成NO的速率加快,且平衡正向移动;4×10-6;
(3)2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应,任何温度下均不能自发进行,根据G=△H-T?△S,G>0,不能实现,
故答案为:不能;△H>0△S<0,所以△H-T△S<0;
(4)汽车尾气系统中装置反应的化学方程式为2CO+2NO
| ||
| ||
(5)铂电极上氧气得电子生成氧离子而被还原,NiO电极上CO失电子和氧离子反应生成二氧化碳,所以电极反应式为CO+O2--2e-=CO2,
故答案为:还原;CO-2e-+O2-=CO2.
点评:该题综合考查化学反应原理的基础知识,涉及化学平衡常数的计算、自由能的应用、原电池原理等,题目难度中等,注意相关知识的积累.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
一定条件下,2SO2(g)+O2(g)═2SO3(g)△H=-197kJ?mol-1.现有容积固定且相同的五个容器,在上述条件下分别充入的气体和反应热△H如表所示:根据以上数据,下列选项正确的是( )
| 容器 | SO2(mol) | O2(mol) | SO3 (mol) | He(mol) | △H(kJ?mol-1) |
| 1 | 2 | 1 | 0 | 0 | △H1 |
| 2 | 1 | 0.5 | 0 | 0 | △H2 |
| 3 | 1 | 0.5 | 0 | 1 | △H3 |
| 4 | 1 | 0.6 | 0 | 0 | △H4 |
| 5 | 0 | 0 | 2 | 0 | △H5 |
| A、△H1=2△H2 |
| B、△H3<△H4 |
| C、△H1+△H5=197 |
| D、△H2=△H3 |
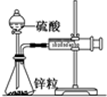 某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol?L-1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是( )
某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol?L-1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是( )| A、用锌粒表示10 s内该反应的速率为0.013 g?s-1 |
| B、忽略锥形瓶溶液体积的变化,用H+来表示10 s该反应的速率0.01 mol?(L?s)-1 |
| C、忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内反应的速率0.01 mol?(L?s)-1 |
| D、用H2表示10 s内该反应的速率为0.004 mol?(L?s)-1 |
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应方程式相同的是( )
| A、Na和O2 |
| B、NaOH和CO2 |
| C、Na2O2和CO2 |
| D、木炭(C)和O2 |
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图Ⅰ表示200℃时容器中各物质的量随时间的变化关系,图Ⅱ表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )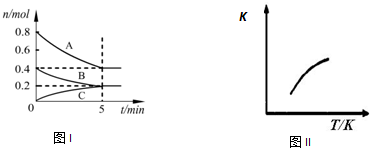

| A、200℃时,反应从开始到平衡的平均速率v(A)=0.08 mol?L-1?min-1 |
| B、若0~5 min时容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol |
| C、200℃时,若在第6 min再向体系中加入催化剂,可使v正>v逆 |
| D、200℃时,平衡后再充入2 mol C,则达到平衡时,化学平衡常数变小 |
已知常温下,AgBr的Ksp=4.9×10-13 mol2?L-2、AgI的Ksp=8.3×10-17 mol2?L-2 下列说法正确的是( )
| A、在常温下AgI水溶液中,Ag+和I-浓度的乘积是一个常数 |
| B、在常温下,在任何含AgI固体的溶液中,c(Ag+)=c(I-)且Ag+与I-浓度的乘积等于8.3×10-17 mol2?L-2 |
| C、常温下,将1mL 1.0×10-2 mol/L的KI与AgNO3溶液等体积混合,则生成AgI沉淀所需AgNO3溶液的最小浓度为3.32×10-14mol/L |
| D、向AgI饱和溶液中加入AgBr固体,c(I-)不变,Ksp值不变 |
 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.