题目内容
已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2),某小组同学设计了如图所示装置(夹持仪器和连接用的乳胶管已经省略).
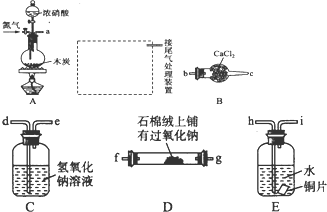
(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为a→ → → → (填仪器接口的字母编号).连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通人氮气的主要目的是 .
(2)简述使用分液漏斗向圆底烧瓶中滴加浓硝酸的操作: .装置E中观察到的主要实验现象有
(3)装置C的作用是 .
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮.装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成: (写出检验步骤及现象).
(5)亚硝酸钠在酸性条件下可将I一氧化为I2,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式: .

(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为a→
(2)简述使用分液漏斗向圆底烧瓶中滴加浓硝酸的操作:
(3)装置C的作用是
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮.装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成:
(5)亚硝酸钠在酸性条件下可将I一氧化为I2,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式:
考点:性质实验方案的设计
专题:
分析:(1)装置B是干燥装置,洗手水以及二氧化碳,C装置中的氢氧化钠可以和二氧化碳之间反应;D是一氧化碳和过氧化钠之间的反应装置;E装置将生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜、一氧化氮和水根据装置的用途来连接仪器;根据NO很容易被氧气氧化为二氧化氮来回答;
(2)根据分液漏斗的使用方法以及E中发生的反应是铜和稀硝酸的反应来回答;
(3)根据C装置中的氢氧化钠可以和二氧化碳之间反应来回答;
(4)根据亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮,一氧化氮不稳定易被氧化为二氧化氮来回答;
(5)根据亚硝酸钠在酸性条件下可将I一氧化为I2,结合氧化还原反应规律来书写.
(2)根据分液漏斗的使用方法以及E中发生的反应是铜和稀硝酸的反应来回答;
(3)根据C装置中的氢氧化钠可以和二氧化碳之间反应来回答;
(4)根据亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮,一氧化氮不稳定易被氧化为二氧化氮来回答;
(5)根据亚硝酸钠在酸性条件下可将I一氧化为I2,结合氧化还原反应规律来书写.
解答:
解:(1)实验原理是:将碳和浓硝酸反应生成的二氧化碳、二氧化氮混合气体通入到E中,二氧化氮可以和水反应生成硝酸,金属铜好硝酸反应生成一氧化氮气体,然后经过氢氧化钠溶液,将其中的二氧化碳吸收,防止干扰实验,此时剩余的气体是NO,用B中的碱石灰进行干燥,最后在D中检验一氧化氮和过氧化钠是否反应是否有亚硝酸钠(NaNO2)产生,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,这样可以排除装置中的空气,防止一氧化氮被空气中的氧气氧化为二氧化氮,
故答案为:hi→de→bc→fg(或gf);排除装置中的空气,防止一氧化氮被空气中的氧气氧化为二氧化氮;
(2)使用分液漏斗向圆底烧瓶中滴加浓硝酸的操作:打开分液漏斗上口的塞子,旋开分液漏斗的旋塞;E装置将生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜、一氧化氮和水,现象是:溶液由无色变成蓝色,有无色气泡冒出,
故答案为:打开分液漏斗上口的塞子,旋开分液漏斗的旋塞;溶液由无色变成蓝色,有无色气泡冒出;
(3)二氧化碳也可以和过氧化钠之间反应,将混合气体经过C中的氢氧化钠溶液,可以将其中的二氧化碳吸收,防止干扰实验,故答案为:除去一氧化氮中的二氧化碳;
(4)根据题意信息:亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮,可以取少量D中的固体于试管中,加入稀硫酸,若溶液中有气泡产生且在试管液面上方变成红棕色气体,则D中有亚硝酸钠生成,反之则没有,
故答案为:取少量D中的固体于试管中,加入稀硫酸,若溶液中有气泡产生且在试管液面上方变成红棕色气体,则D中有亚硝酸钠生成;
(5)亚硝酸钠在酸性条件下可将I一氧化为I2,本身的还原产物是NO,即2NO2-+2I-+4H+=2NO+I2+2H2O,
故答案为:2NO2-+2I-+4H+=2NO+I2+2H2O.
故答案为:hi→de→bc→fg(或gf);排除装置中的空气,防止一氧化氮被空气中的氧气氧化为二氧化氮;
(2)使用分液漏斗向圆底烧瓶中滴加浓硝酸的操作:打开分液漏斗上口的塞子,旋开分液漏斗的旋塞;E装置将生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜、一氧化氮和水,现象是:溶液由无色变成蓝色,有无色气泡冒出,
故答案为:打开分液漏斗上口的塞子,旋开分液漏斗的旋塞;溶液由无色变成蓝色,有无色气泡冒出;
(3)二氧化碳也可以和过氧化钠之间反应,将混合气体经过C中的氢氧化钠溶液,可以将其中的二氧化碳吸收,防止干扰实验,故答案为:除去一氧化氮中的二氧化碳;
(4)根据题意信息:亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮,可以取少量D中的固体于试管中,加入稀硫酸,若溶液中有气泡产生且在试管液面上方变成红棕色气体,则D中有亚硝酸钠生成,反之则没有,
故答案为:取少量D中的固体于试管中,加入稀硫酸,若溶液中有气泡产生且在试管液面上方变成红棕色气体,则D中有亚硝酸钠生成;
(5)亚硝酸钠在酸性条件下可将I一氧化为I2,本身的还原产物是NO,即2NO2-+2I-+4H+=2NO+I2+2H2O,
故答案为:2NO2-+2I-+4H+=2NO+I2+2H2O.
点评:本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,注意实验过程中的反应现象分析,掌握基础是关键,题目难度中等.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应方程式相同的是( )
| A、Na和O2 |
| B、NaOH和CO2 |
| C、Na2O2和CO2 |
| D、木炭(C)和O2 |
室温下由水电离的c(H+)=1×10-14 mol?L-1的溶液中一定不可以大量共存的是离子组是( )
| A、Na+、K+、Cl-、CO32- |
| B、Mg2+、NH4+、Cl-、NO3- |
| C、CH3COO-、SO42-、Ba2+、K+ |
| D、Fe2+、Cl-、NO3-、Ba2+ |
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图Ⅰ表示200℃时容器中各物质的量随时间的变化关系,图Ⅱ表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )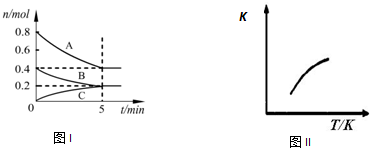

| A、200℃时,反应从开始到平衡的平均速率v(A)=0.08 mol?L-1?min-1 |
| B、若0~5 min时容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol |
| C、200℃时,若在第6 min再向体系中加入催化剂,可使v正>v逆 |
| D、200℃时,平衡后再充入2 mol C,则达到平衡时,化学平衡常数变小 |
下列溶液中各微粒的浓度关系正确的是( )
| A、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH4+大小顺序为①>②>③ |
| B、pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
| C、0.2 mol?L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| D、0.2 mol?L-1 HCl与0.1 mol?L-1 NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
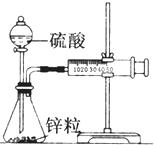 某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.
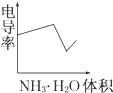
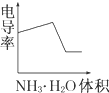
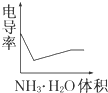
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下. 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.