题目内容
25℃时,水的电离达到平衡:H2O?H++OH-△H>0,下列叙述正确的是( )
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| C、向水中加入氯化钠溶液,c(H+)不变,n(H+)变大 |
| D、将水加热,Kw增大,pH不变 |
考点:水的电离
专题:
分析:A、氨水是弱碱,加入后溶液中的氢氧根浓度增大;
B、硫酸氢钠是强电解质,溶于水电离出氢离子,溶液中氢离子浓度增大,温度不变,Kw不变;
C、加入氯化钠溶液后,溶液中c(H+)不变,n(H+)变大;
D、水的电离是吸热反应,升高温度,氢离子浓度增大,pH减小.
B、硫酸氢钠是强电解质,溶于水电离出氢离子,溶液中氢离子浓度增大,温度不变,Kw不变;
C、加入氯化钠溶液后,溶液中c(H+)不变,n(H+)变大;
D、水的电离是吸热反应,升高温度,氢离子浓度增大,pH减小.
解答:
解:A、向水中加入稀氨水,氨水是弱电解质,电离的氢氧根使溶液中氢氧根浓度增大,平衡逆向移动,但是溶液中的氢氧根浓度升高,故A错误;
B、由于硫酸氢钠是强电解质,加入后,溶液中的氢离子浓度增大,平衡向逆向移动,但是溶液中的氢离子浓度增大;由于温度不变KW不变,故B错误;
C、通入氯化钠溶液后,溶液仍呈中性,故溶液中c(H+)不变,但溶液体积变大,故n(H+)变大,故C正确;
D、△H>0,反应吸热,温度升高,平衡正向移动,溶液中氢离子浓度增大,pH降低,故D错误;
故选C.
B、由于硫酸氢钠是强电解质,加入后,溶液中的氢离子浓度增大,平衡向逆向移动,但是溶液中的氢离子浓度增大;由于温度不变KW不变,故B错误;
C、通入氯化钠溶液后,溶液仍呈中性,故溶液中c(H+)不变,但溶液体积变大,故n(H+)变大,故C正确;
D、△H>0,反应吸热,温度升高,平衡正向移动,溶液中氢离子浓度增大,pH降低,故D错误;
故选C.
点评:本题考查外界条件对弱电解质水的电离平衡的影响,注意加入酸、碱,平衡逆向移动,但是溶液中的氢离子或者氢氧根浓度反而增大,本题难度中等.

练习册系列答案
相关题目
室温下由水电离的c(H+)=1×10-14 mol?L-1的溶液中一定不可以大量共存的是离子组是( )
| A、Na+、K+、Cl-、CO32- |
| B、Mg2+、NH4+、Cl-、NO3- |
| C、CH3COO-、SO42-、Ba2+、K+ |
| D、Fe2+、Cl-、NO3-、Ba2+ |
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图Ⅰ表示200℃时容器中各物质的量随时间的变化关系,图Ⅱ表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )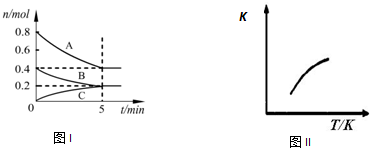

| A、200℃时,反应从开始到平衡的平均速率v(A)=0.08 mol?L-1?min-1 |
| B、若0~5 min时容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol |
| C、200℃时,若在第6 min再向体系中加入催化剂,可使v正>v逆 |
| D、200℃时,平衡后再充入2 mol C,则达到平衡时,化学平衡常数变小 |
下列事实与氢键有关的是( )
| A、水加热到很高的温度都难以分解 |
| B、水结成冰体积膨胀,密度变小 |
| C、CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D、HCl的稳定性强于HBr |
配制一定物质的量浓度的NaOH溶液时,可造成所配溶液浓度偏高的是( )
| A、所用NaOH已吸潮 |
| B、摇匀后液面低于刻度线,不再补加水 |
| C、有少量NaOH溶液残留在烧杯内 |
| D、向容量瓶加水至时刻度线时俯视液面 |
氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq)+OH-(aq)?F-(aq)+H2O(l)△H=-67.7kJ/mol
H+(aq)+OH-(aq)?H2O(l)△H=-57.3kJ/mol
在10mL 0.1mol/L的NaOH溶液中,加入10mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是( )
HF(aq)+OH-(aq)?F-(aq)+H2O(l)△H=-67.7kJ/mol
H+(aq)+OH-(aq)?H2O(l)△H=-57.3kJ/mol
在10mL 0.1mol/L的NaOH溶液中,加入10mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是( )
| A、当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) |
| B、水电离的热化学方程式为:H2O(1)?H+(aq)+OH-(aq)△H=+57.3kJ/mol |
| C、当c>0.1时,一定不存在:c(Na+)=c(F-) |
| D、若混合后溶液中:c(Na+)>c(OH-)>c(F-)>c(H+),则c一定小于0.1 |